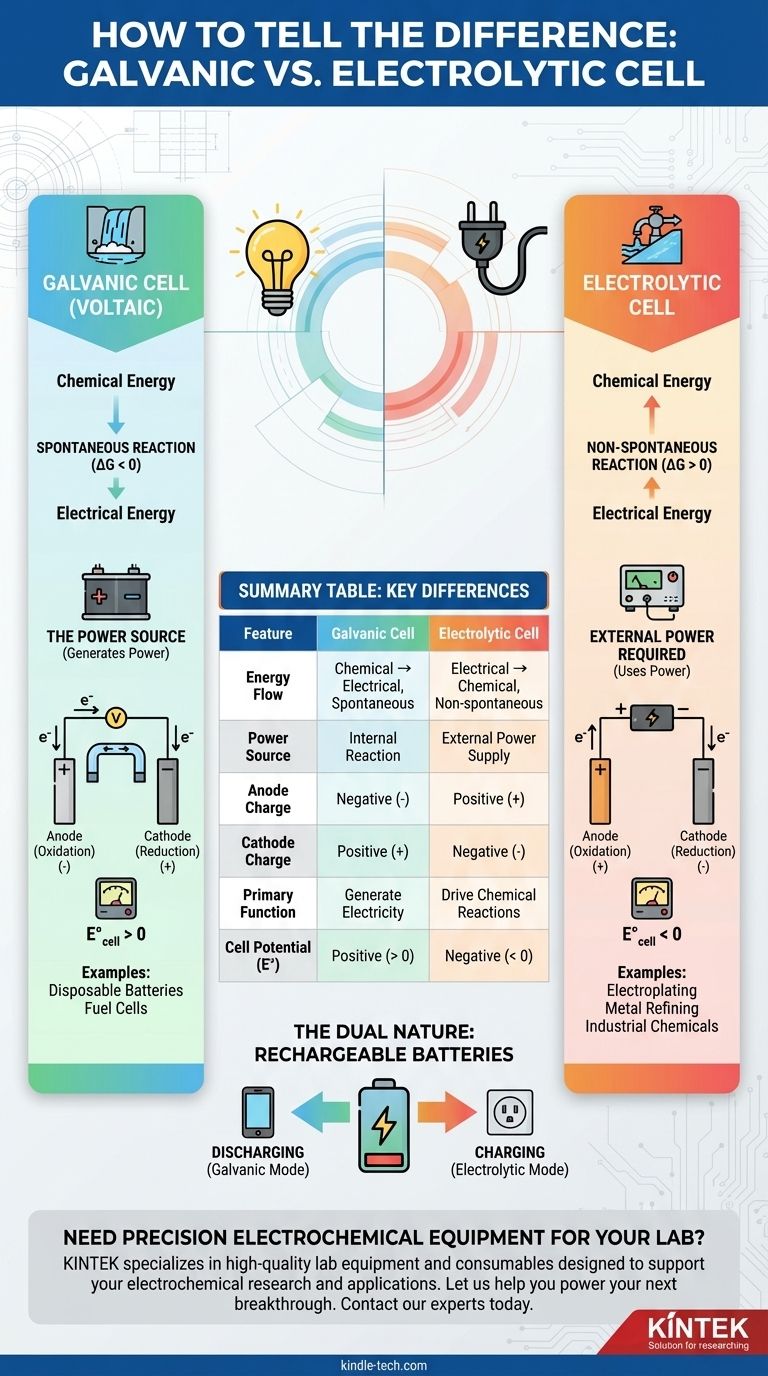
原电池和电解池的根本区别在于能量的流动。 原电池,也称为伏打电池,利用自发化学反应产生电能。相反,电解池利用外部电能强制发生非自发化学反应。
可以这样理解:原电池就像瀑布自然下落产生电力。电解池就像水泵利用外部电力将水逆着重力推上山。
核心原理:自发性与能量转换
任何电化学电池的行为都取决于其内部反应是自行发生还是需要外部干预。
原电池:释放化学能
原电池的定义是发生自发氧化还原反应。这意味着反应会自行发生,并在此过程中释放能量。
这个过程将储存的化学能直接转化为电能。电池本身就是电源。
从热力学角度看,这对应于负的吉布斯自由能(ΔG < 0)和正的电池电位(E°_cell > 0)。
电解池:输入电能
电解池涉及非自发反应。如果没有外部推动,这种反应就不会发生。
它需要外部电源,如电池或直流电源,来驱动反应进行。这个过程将电能转化为化学能。
这对应于正的吉布斯自由能(ΔG > 0)和负的电池电位(E°_cell < 0)。外部电压必须大于这个负电位才能强制反应发生。

如何识别每种电池:关键指标
除了能量流动的方向,您还可以通过观察电极极性和整体电路来区分这两种电池。
电源
这是最直接的指标。如果电化学电池是为设备供电的电池,它就是原电池。
如果电池连接到外部电池或电源,它就是电解池。外部电源提供能量来驱动该过程。
电极极性(一个常见的混淆点)
阳极和阴极的定义对于两种电池类型都是不变的:
- 阳极: 发生氧化的电极。
- 阴极: 发生还原的电极。
然而,它们的正/负电荷(极性)会翻转:
在原电池中,阳极的自发反应释放电子,使其成为负极 (-)。阴极消耗电子,是正极 (+)。
在电解池中,外部电源决定极性。它将电子从阳极拉走,使其成为正极 (+),并将电子推向阴极,使其成为负极 (-)。
常见应用和误区
电池的用途是其最实用的区别。一个产生电力,另一个利用电力产生物质或改变物质。
原电池的用途
原电池的唯一功能是作为电源。
常见例子包括一次性电池(AA、AAA)、燃料电池以及汽车电池启动发动机时的主要功能。
电解池的用途
电解池的目标是驱动有用的化学转化,否则这种转化不会发生。
典型应用包括在表面电镀一层薄金属、精炼铜和铝等金属,以及生产氯气等工业化学品。
可充电电池的双重性质
可充电电池是两种电池类型合二为一的完美例子。
- 放电时(为手机供电): 它充当原电池,通过自发反应产生电能。
- 充电时(插入电源): 它充当电解池,外部能量强制发生非自发逆反应以储存能量。
根据您的目标进行正确区分
要快速确定您正在处理哪种电池,请关注能量流和系统的总体目标。
- 如果您的主要重点是发电: 您正在处理的是原电池,其中自发反应释放能量。
- 如果您的主要重点是制造物质或逆转反应: 您正在使用电解池,它需要外部电源来驱动非自发过程。
- 如果您正在分析电极符号: 请记住,在原电池中阳极是负极,而在电解池中阳极是正极,因为能量来源是内部或外部的。
最终,了解能量是产物还是需求是区分这两种基本电化学电池的关键。
总结表:
| 特征 | 原电池 | 电解池 |
|---|---|---|
| 能量流向 | 化学能 → 电能(自发) | 电能 → 化学能(非自发) |
| 电源 | 内部反应 | 外部电源 |
| 阳极电荷 | 负极 (-) | 正极 (+) |
| 阴极电荷 | 正极 (+) | 负极 (-) |
| 主要功能 | 产生电能 | 驱动化学反应(例如电镀) |
| 电池电位 (E°) | 正值 (> 0) | 负值 (< 0) |
您的实验室需要精密电化学设备吗?
了解原电池和电解池的细微差别对于高级实验室工作至关重要。无论您是开发新的电池技术、进行电镀还是材料分析,拥有合适的设备都必不可少。
KINTEK 专注于高品质实验室设备和耗材,旨在支持您的电化学研究和应用。我们提供可靠的解决方案,确保准确的结果并提高您实验室的效率。
让我们帮助您实现下一个突破。 立即联系我们的专家,讨论您的具体实验室需求,并了解我们的产品如何推动您的成功。
图解指南