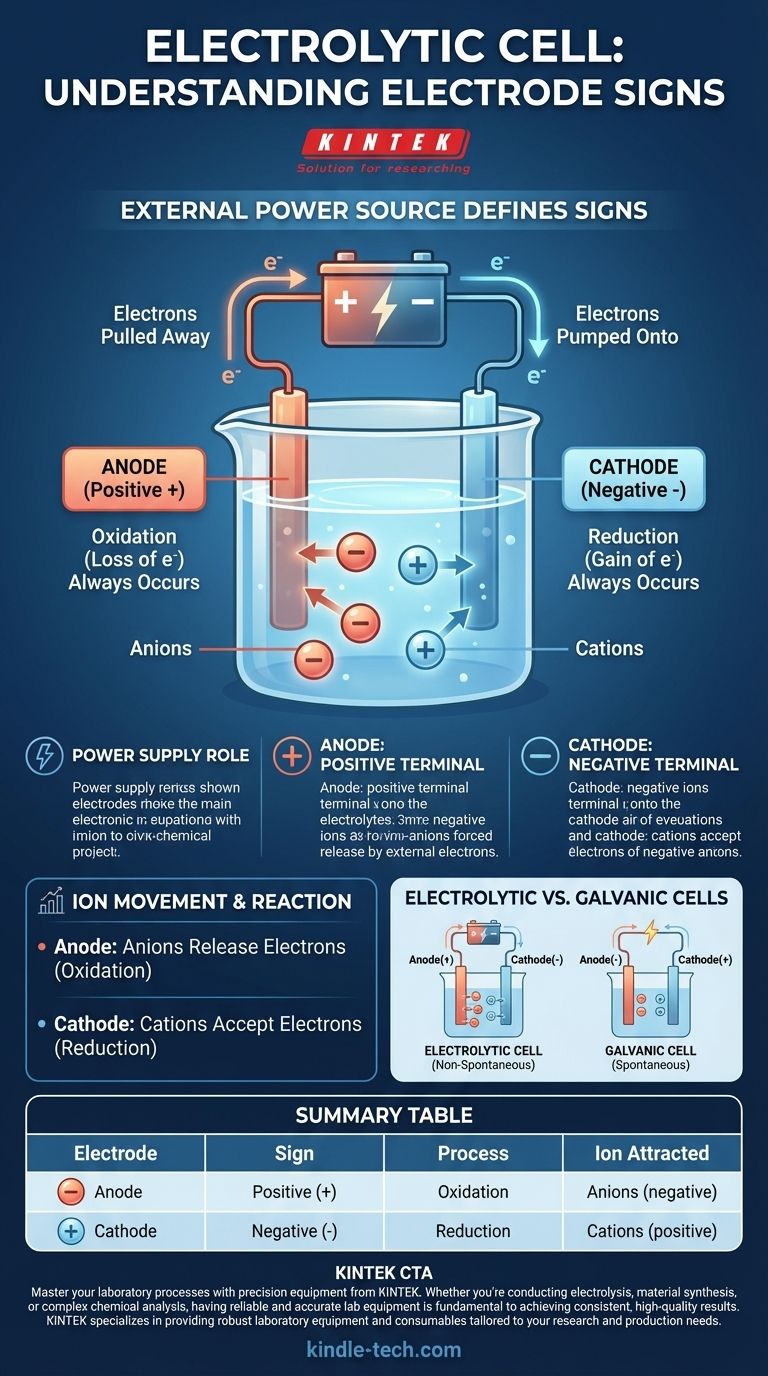
在电解池中,符号约定由外部电源定义。 阳极被指定为正(+)号,而 阴极被指定为负(-)号。这是因为施加了外部电压以驱动不会自发发生的化学反应。
理解电解池的关键在于认识到它不是一个自给自足的系统。其电极的符号完全由其连接的外部电源决定,迫使发生非自发的化学变化。
为什么外部电源定义了符号
电解池利用电能来产生化学能。这个过程被称为电解,需要外部力量——电池或直流电源——来启动和维持反应。
电源的作用
电源充当“电子泵”。它将电子从一个电极中吸走并将其推送到另一个电极,产生电荷不平衡,迫使电解质溶液中的离子发生反应。
阳极连接到正极
外部电源的正极连接到阳极。该终端会主动地将电子从阳极拉走,使其带有净正电荷。
阴极连接到负极
相反,电源的负极连接到阴极。该终端会主动地将电子泵入阴极,使其电子过剩并带有净负电荷。

离子运动如何产生反应
电极上被强制施加的电荷正是吸引电解质中溶解的离子的原因,迫使它们移动和反应。氧化和还原的基本定义在所有情况下都保持不变。
阳极:氧化发生的位置(始终如此)
无论电池类型如何,氧化(电子的损失)始终发生在阳极。在电解池中,带负电荷的离子(阴离子)被吸引到带正电的阳极,在那里它们释放出多余的电子并被氧化。
阴极:还原发生的位置(始终如此)
同样,还原(电子的获取)始终发生在阴极。溶液中带正电的离子(阳离子)被吸引到带负电的阴极,在那里它们接受多余的电子并被还原。
一个关键区别:电解池与原电池
当将电解池与原电池(或伏打电池),例如标准电池进行比较时,一个主要的困惑来源出现了。它们的符号约定是相反的,原因非常特殊。
自发反应与非自发反应
原电池依靠自发的化学反应来产生电能。在这里,阳极是电子的自然来源,使其带负电,而阴极是电子被消耗的地方,使其带正电。
电解池进行非自发的化学反应,消耗电能。外部电源会反转自然极性,以强制反应进行。
普遍的常数
尽管符号不同,但这两种电池类型中的核心过程是相同的:
- 阳极始终是氧化的发生地。
- 阴极始终是还原的发生地。
如何记住这些符号
根据您的目标,使用这些原则来清晰地记住约定。
- 如果您的主要重点是识别电极: 请记住,在电解池中,符号与外部电源匹配:阳极为正,阴极为负。
- 如果您的主要重点是追踪离子: 遵循异性电荷的简单规则:带负电的阴离子移向带正电的阳极,带正电的阳离子移向带负电的阴极。
- 如果您的主要重点是区分电池类型: 将“电解”与强制阳极带正电荷和阴极带负电荷以驱动反应的外部电源相关联。
最终,电解池的符号是外部电源覆盖化学反应自然流动的直接结果。
总结表:
| 电极 | 符号 | 过程 | 吸引的离子 |
|---|---|---|---|
| 阳极 | 正(+) | 氧化 | 阴离子(负) |
| 阴极 | 负(-) | 还原 | 阳离子(正) |
使用 KINTEK 的精密设备掌握您的实验室流程。
无论您是进行电解、材料合成还是复杂的化学分析,拥有可靠和准确的实验室设备对于实现一致、高质量的结果至关重要。KINTEK 专注于提供满足您的研究和生产需求的坚固耐用的实验室设备和耗材。
立即联系我们的专家,讨论我们的解决方案如何为您的创新提供动力并提高实验室工作流程的效率。
图解指南