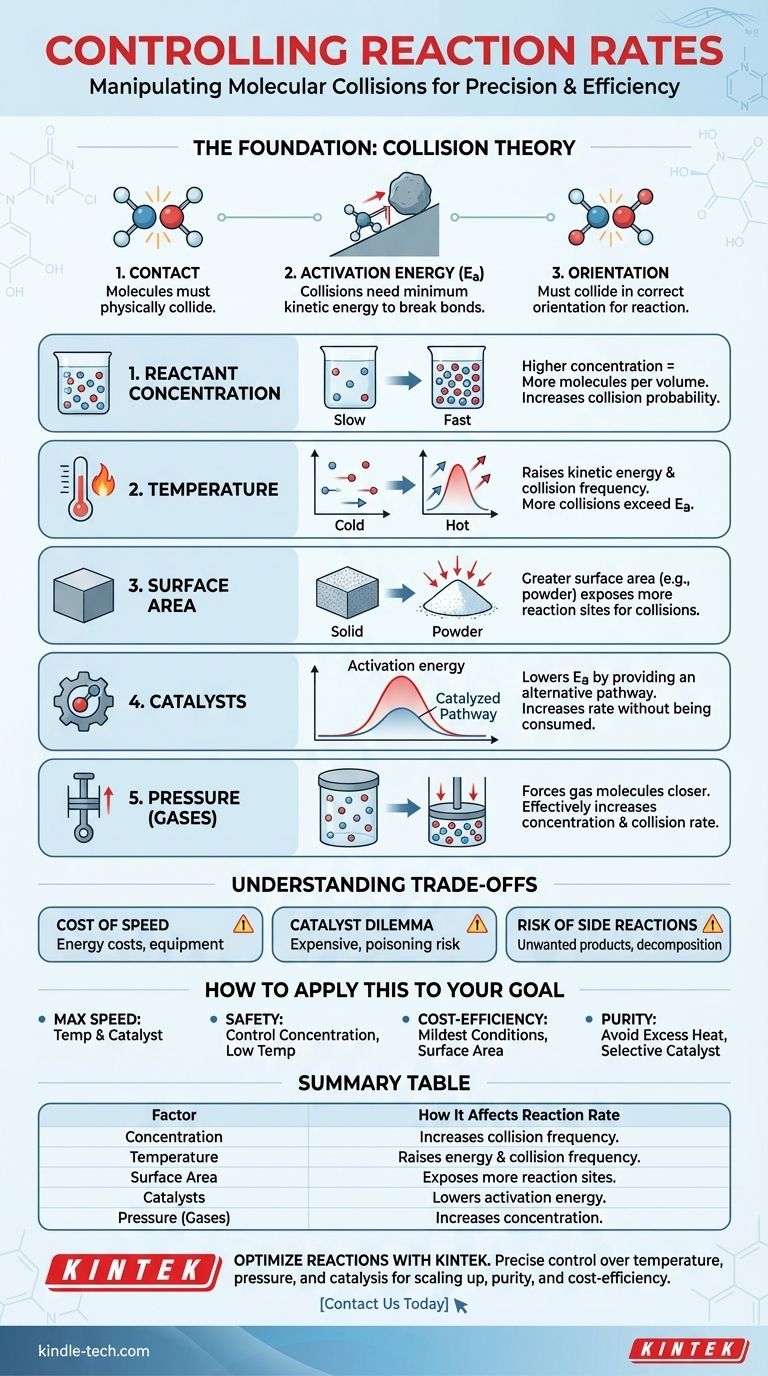
从本质上讲,有五个主要因素控制着化学反应的速率:反应物的浓度、温度、反应物的物理状态和表面积、催化剂的存在,以及对于气体而言的压力。所有这些因素都会影响分子碰撞的频率和能量,这是所有化学变化的基本驱动力。
任何化学反应的速度都取决于反应物分子以正确的取向和足够高的能量发生碰撞的频率,以克服反应的活化能垒。所有控制反应速率的因素都只是一个用于控制这些碰撞的频率和有效性的杠杆。
基础:碰撞理论
要控制反应,您必须首先了解反应不是瞬时发生的。它们是分子之间物理相互作用的结果。碰撞理论解释了这一点。
接触的必要性
要发生反应,反应物分子必须相互物理碰撞。如果它们在不同的容器中,则不会发生反应。反应速率直接与这些碰撞的速率相关。
能量要求(活化能)
仅有碰撞是不够的。碰撞的分子必须具有一定的最小动能,称为活化能 (Ea)。需要这种能量来打破现有的化学键,以便形成新的化学键。
将活化能想象成您必须推动一块巨石越过的小山。轻微的推动(低能碰撞)不会起任何作用。您需要提供足够的推力(足够的能量)才能使其到达山顶,然后它才能滚到另一边并释放能量。
取向因素
最后,分子必须以特定的取向碰撞,才能使正确的键断裂并形成新的键。一次角度错误的随机碰撞,即使能量足够,也不会导致反应。

控制反应速率的五个杠杆
了解碰撞理论为您提供了五个可以拉动的不同杠杆,以加速或减慢反应。每一个的作用都是通过影响碰撞频率、碰撞能量或活化能垒本身来实现的。
1. 反应物浓度
增加反应物的浓度意味着在给定体积内聚集了更多的分子。这直接增加了它们碰撞的概率,从而提高了反应速率。
2. 温度
提高温度具有强大的双重作用。首先,它增加了分子的动能,使它们移动得更快,碰撞更频繁。其次,也是更重要的一点,它增加了这些碰撞的能量,意味着更高比例的碰撞将具有克服活化能垒所需的能量。
3. 物理状态和表面积
这对于涉及不同相的反应(例如固体与液体反应,即多相反应)最为重要。固体块具有有限的发生碰撞的表面积。将同一块固体研磨成细粉末会极大地增加其表面积,暴露更多的分子并产生更多的反应位点。
4. 催化剂
催化剂在不被消耗的情况下提高反应速率。它通过提供具有较低活化能的替代反应路径来实现这一点。
回到我们的类比,催化剂就像在山上挖了一条隧道。您不再需要将巨石推到山顶;您可以用少得多的力气让它到达另一边。这使得更多的分子即使在较低的温度下也能成功反应。
5. 压力(针对气态反应)
对于涉及气体的反应,增加压力会将气体分子推得更近。这实际上等同于增加它们的浓度,从而导致更频繁的碰撞和更快的反应速率。
了解权衡
操纵反应速率并非没有后果。一个有效的技术顾问必须考虑每种选择的实际和经济影响。
速度的代价
提高温度和压力需要能源,这需要花费金钱。它还可能需要昂贵且难以维护的专业高压反应器,从而带来安全方面的考虑。
催化剂的困境
催化剂可能非常有效,但通常很昂贵(例如,使用铂或钯等贵金属)。它们也可能对单一反应具有很强的特异性,并且可能因杂质而失活,这个过程被称为“催化剂中毒”。
不需要的副反应的风险
过度推动反应,尤其是在过高温度下,可能导致不良后果。反应物或产物可能开始分解,或者增加的能量可能促使不需要的副反应发生,从而降低所需产物的纯度和产率。
如何将其应用于您的目标
您控制反应的策略完全取决于您试图实现的目标。
- 如果您的主要重点是最大速度: 最有力的杠杆是提高温度和使用有效的催化剂,因为两者都会极大地增加成功、高能碰撞的数量。
- 如果您的主要重点是安全和控制: 小心地管理反应物浓度(例如,将一种反应物缓慢添加到另一种反应物中)和使用最低有效温度是最佳方法。
- 如果您的主要重点是成本效益: 优化在最温和的条件下进行。这可能涉及寻找负担得起的催化剂或增加表面积,以避免极端热量和压力的能源成本。
- 如果您的主要重点是产品纯度: 避免可能导致分解或副反应的过高温度,并确保您的催化剂对所需反应具有高选择性。
最终,控制化学反应是一门精确管理控制分子碰撞条件的艺术。
总结表:
| 因素 | 它如何影响反应速率 |
|---|---|
| 浓度 | 较高的浓度增加了反应物分子之间碰撞的频率。 |
| 温度 | 提高了分子能量和碰撞频率;更多的碰撞超过了活化能。 |
| 表面积 | 更大的表面积(例如,粉末状固体)暴露了更多的反应位点用于碰撞。 |
| 催化剂 | 通过提供替代反应路径来降低活化能。 |
| 压力(气体) | 增加了气体分子浓度,导致碰撞更频繁。 |
使用 KINTEK 的精密设备优化您的化学反应。 无论您是扩大生产规模、确保产品纯度,还是最大限度地提高成本效益,我们的实验室设备和耗材都旨在让您精确控制反应条件。让我们的专家帮助您为您的特定需求选择正确的工具来管理温度、压力和催化。立即联系我们,讨论我们如何支持您的实验室取得成功!
图解指南