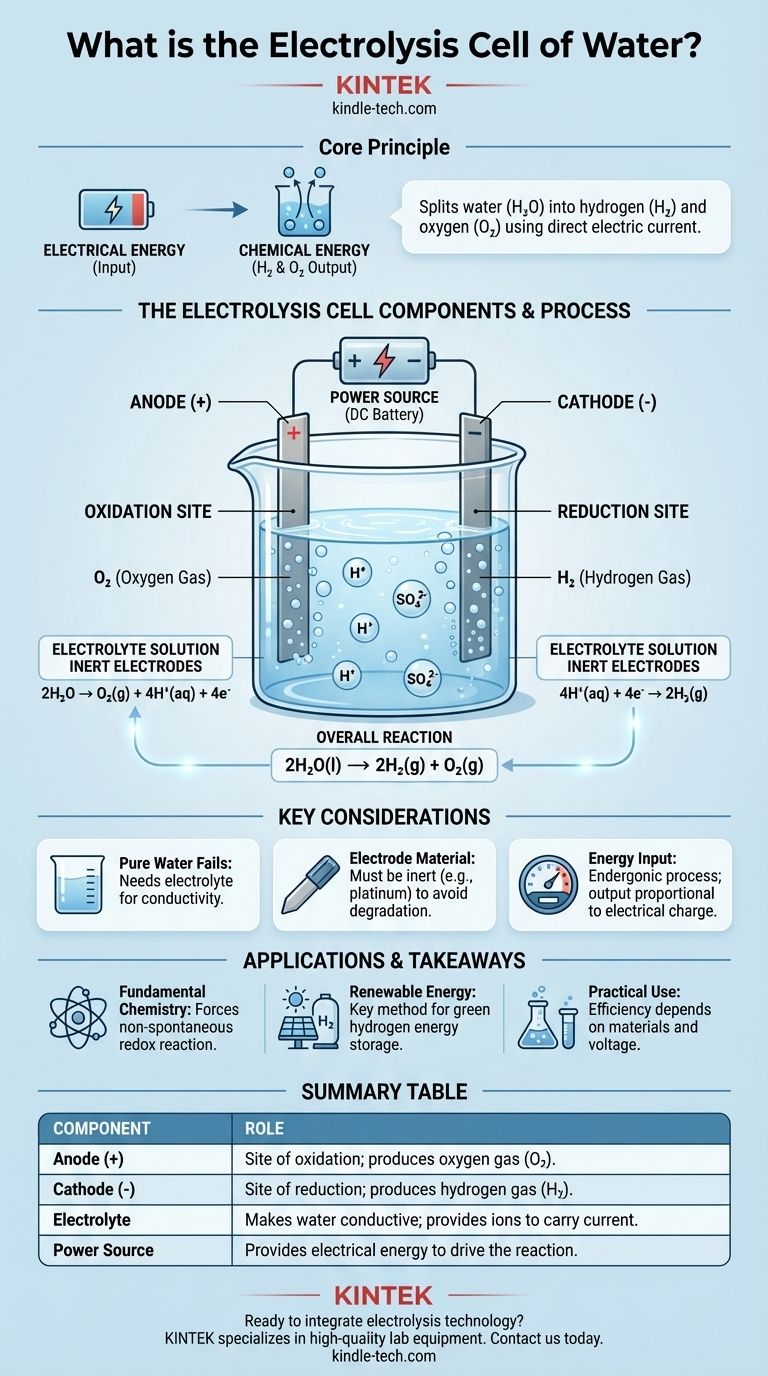
从核心来看,水电解槽是一种利用电能将水(H₂O)分解为其组成元素:氢气(H₂)和氧气(O₂)的装置。它通过让直流电流通过含有少量电解质的水来完成这一过程,从而强制发生不会自行发生的化学变化。其基本组件是两个浸没在电解质中并连接到外部电源的电极(阳极和阴极)。
电解槽的核心目的是将电能转化为化学能。它利用外部电压驱动非自发的氧化还原反应,有效地将输入的能量储存在生成的氢气和氧气分子的化学键中。
核心组件及其作用
水电解槽通过电极、电解质和电源这三个关键部分的精确相互作用来运行。每个部分都在此过程中扮演着独特而关键的角色。
电极:阳极和阴极
电池包含两个电极,它们是电流进出溶液的导体。这些电极通常由惰性材料制成,如铂或石墨,以确保它们促进反应而不会被消耗。
阳极是正极。这是氧化的场所,物质在此处失去电子。
阴极是负极。这是还原的场所,物质在此处获得电子。
电解质:使水导电
纯水是电的不良导体,因为它含有太少的自由移动离子来有效传导电流。
为了解决这个问题,会添加少量电解质,例如硫酸(H₂SO₄)。电解质溶解在水中并提供移动离子(在这种情况下是 H⁺ 和 SO₄²⁻),这些离子可以在电极之间传输电荷,从而完成电路。
电源:驱动反应
分解水是一个吸能反应,这意味着它需要能量输入才能发生。水是稳定的,不会自发分解。
外部电源,如电池或直流电源,提供必要的电压。这种电压力将电子“推入”阴极并从阳极“拉出”电子,从而强制水发生化学分解。

化学过程:水如何分解
整个过程是一个氧化还原反应,分为在每个电极上发生的两个不同的半反应。
阳极 (+) 处的氧化
在正阳极,水分子被氧化。它们释放出电子,然后电子流出电池进入外部电路。
该反应产生氧气(O₂)和氢离子(H⁺)。半反应是:2H₂O → O₂(g) + 4H⁺(aq) + 4e⁻
阴极 (-) 处的还原
在阳极产生的氢离子(H⁺)(以及酸性电解质中存在的氢离子)被吸引到负阴极。
在阴极,这些离子获得从外部电路流入的电子。这种还原反应产生氢气(H₂)。半反应是:4H⁺(aq) + 4e⁻ → 2H₂(g)
总反应
当您将两个半反应结合起来时,两侧的电子和氢离子相互抵消,揭示了水电解的简单而优雅的总体结果。
净化学变化是:2H₂O(l) → 2H₂(g) + O₂(g)。每分解两个水分子,就产生两个氢气分子和一个氧气分子。
理解关键考虑因素
虽然概念简单明了,但有几个因素对于电池的正确和高效运行至关重要。了解这些限制揭示了该过程的真正性质。
为什么纯水会失效
如果没有电解质,水的电阻极高。施加电压将导致可忽略不计的电流流动,因此几乎不会产生氢气或氧气。电解质不会被消耗;它的唯一作用是充当电荷载体。
电极材料至关重要
使用惰性电极如铂是必不可少的。如果您使用锌或铜等活性金属作为阳极,阳极本身将被氧化并溶解到溶液中,而不是水。这将产生不同的、意想不到的产物并损坏电极。
能量输入决定输出
电解不是自由能源的来源;它是一个能量转换过程。产生的氢气和氧气的量与通过电池的电荷量成正比。生产少量氢气需要大量的电能。
为您的目标做出正确选择
了解电解槽对于多个学科都很有价值。您的收获取决于您的根本目标。
- 如果您的主要重点是基础化学: 将此视为电能如何强制非自发氧化还原反应,将稳定化合物分离成其元素的完美演示。
- 如果您的主要重点是可再生能源: 认识到电解是能量储存的关键方法,将太阳能或风能等来源的过剩电力转化为氢燃料。
- 如果您的主要重点是实际应用: 请记住,电解的效率、速率和产物完全取决于所使用的特定材料——电解质、电极材料和施加的电压。
最终,水电解是一个强大的过程,它利用电力来释放简单分子中储存的化学能。
总结表:
| 组件 | 在电解槽中的作用 |
|---|---|
| 阳极(正极) | 氧化场所;产生氧气(O₂)。 |
| 阴极(负极) | 还原场所;产生氢气(H₂)。 |
| 电解质 | 使水导电;提供离子以传导电流。 |
| 电源 | 提供电能以驱动非自发反应。 |
准备好将电解技术整合到您的实验室工作流程中了吗? KINTEK 专注于为先进化学过程提供高质量的实验室设备和耗材。无论您是开发新能源储存解决方案还是进行基础研究,我们的专业知识都能确保您拥有所需的可靠设备。立即联系我们的团队,讨论我们如何支持您的特定实验室需求。
图解指南