电解池的定义和基本功能
目录
了解电解池中电能和化学能的作用
电化学电池 电化学电池是一种能够通过化学反应产生电能或通过引入电能促进化学反应的装置。
定义电化学 电化学是一门研究导致电子移动的化学过程的学科。它涉及电能和化学变化之间的相互作用。
举例说明:研究电化学电池就属于电化学。它涉及将化学能转化为电能的电池。
电化学的重要性 电化学研究电现象和化学现象之间的关系。电化学过程应用于各行各业。它是生产多种化学品的最重要过程。各种金属的生产都以电化学方法为基础。氢是通过电解水制造的。它在电动汽车的发展中也发挥着重要作用。
说明电解池的组成部分,包括电极和电解液
电解池由 3 个基本组件组成。

阳极是负极或还原极,在电化学反应中向外电路释放电子并氧化。
阴极是正极或氧化电极,从外电路中获得电子,在电化学反应中被还原。
电解质是在电池的阴极和阳极之间提供离子传输机制的介质。电解质通常被认为是水或其他溶剂等液体,其中含有离子传导所需的溶解盐、酸或碱。但需要注意的是,包括传统(AA/AAA/D)电池在内的许多电池都含有固体电解质,在室温下可作为离子导体。
选择阴极、阳极和电解液时的注意事项
阳极、阴极和电解质材料的理想特性如下。
电极和离子之间的电荷转移过程说明
电解池,任何将电能转化为化学能或反之亦然的装置。这种电解池通常由两个金属或电子导体(电极)组成,彼此分开并与电解质(q.v.)接触,电解质通常是一种溶解或融合的离子化合物。将电极与直流电源连接后,其中一个电极带负电,另一个电极带正电。电解质中的正离子迁移到负极(阴极),在那里与一个或多个电子结合,失去部分或全部电荷,成为电荷较低的新离子或中性原子或分子;与此同时,负离子迁移到正极(阳极),将一个或多个电子转移到正极,也成为新离子或中性粒子。这两个过程的总体效果是电子从负离子转移到正离子,这是一种化学反应(见氧化还原反应)。一个例子是电解氯化钠(普通盐),形成金属钠和氯气;使反应进行所需的能量由电流提供。电解的其他常见应用包括用于精炼或电镀金属的电沉积以及生产烧碱。
什么是电解池?电解池可定义为利用电能促进非自发氧化还原反应的电化学装置。电解池是一种可用于电解某些化合物的电化学电池。例如,水可以通过电解(借助电解池)形成气态氧和气态氢。这是通过利用电子流(进入反应环境)来克服非自发氧化还原反应的活化能障碍来实现的。


电解槽的三个主要部件是阴极(在电解槽中为负电荷) 阳极(在电解槽中为正电荷) 电解质 电解质为阴阳两极之间的电子交换提供介质。电解池中常用的电解质包括水(含有溶解离子)和熔融氯化钠。
电解池 要定义电解池,我们首先需要了解电解。电解法是一种将电流通过含有离子的液体,使其中的化合物分解的方法。这种方法用于从金属元素中分离金属、分离其他化学物质(如水)、电镀金属和给电池充电。一个完整的电路对维持电解过程至关重要;我们需要能够从电池中持续汲取电能。
电解池的阴极和阳极与电源相连。每个电解池中都有这两个稳定的电极和流体电解质溶液。电解质溶液可以导电,因为溶解的离子可以在溶液中自由移动。
电解池及其组件 电解池由电池、电极和电解液三个主要组件组成。电池 电池起电源作用。它提供电能以实现化学变化,即离子化合物的分解。电极 电极是关闭或完成导线与电解液之间电路的电触点。电极的例子包括碳棒(石墨)和金属板。左边(参考上图)与电池正极相连的电极是正极或阳极。右边与电池负极相连的电极是负极或阴极。电解质 电解质是一种在熔融或水溶液中含有可移动离子的物质,可以导电。电解质的例子包括熔融氯化钠、硫酸铜溶液和酸,如稀盐酸。非电解质的例子包括糖溶液、乙醇、(熔融)硫磺,因为这些都是不含可导电的移动离子的液体或溶液。

应用 电解池通常用于分解化合物,其过程称为电解,"electrolysis"("电")是电的意思,希腊语 "lysis"("裂解")是分解的意思。电解的重要例子包括将水分解成氢气和氧气,以及将铝土矿分解成铝和其他化学物质。电镀(如铜、银、镍或铬)是使用电解池进行的。电解是一种使用直流电的技术。
在商业上,电解槽用于几种有色金属的电精炼和电解。大多数高纯度铝、铜、锌和铅都是在电解槽中进行工业生产的。
电解槽 电解槽的三个组成部分是电解质和两个电极。
电解质 电解质是指溶解在水(等极性溶剂)中能产生导电溶液的物质。这是因为电解质溶解在极性溶剂中时,会分解成阳离子和阴离子,并均匀地分布在整个溶液中。这些阳离子和阴离子在溶液的电势作用下分别向电子丰富和电子不足的电极移动。阳离子和阴离子以相反的方向运动,产生电流,形成电解池。
盐、酸和碱可以形成电解质,少数气体在某些条件下也可以像电解质一样,例如氯化氢在高温和低压下。
电解池中的化学反应
电解池中氧化还原反应的解释
在电化学电池中,会发生氧化-还原(氧化还原)反应。电化学电池分为两类:发生自发反应的电化学(伏打)电池和发生非自发反应的电解电池。
这两种电池都有发生氧化和还原反应的电极。氧化反应发生在称为阳极的电极上,还原反应发生在称为阴极的电极上。
在电解池中,阳极为正极,阴极为负极。这是因为阳极会吸引溶液中的阴离子。另一方面,在电解池中,阳极带负电,因为阳极的自发氧化是电解池电子或负电荷的来源。电解池的阴极是其正极。
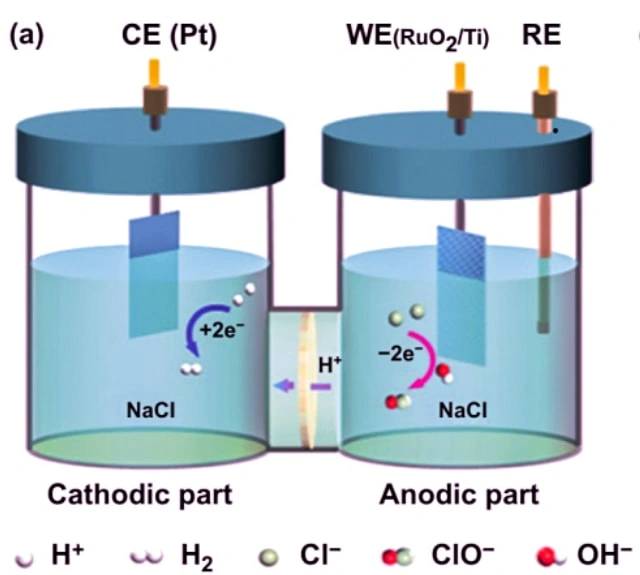
电解氯化钠的例子
电解池的一个例子是电解氯化钠。当氯化钠溶解在水中并进行电解时,会发生以下反应:
在阴极:2 H2O + 2 e- -> 2 OH- + H2
在阳极2 Cl- -> Cl2 + 2 e-
总反应:2 NaCl + 2 H2O -> 2 Na + Cl2 + H2 + 2 OH-
在这个电解池中,两个惰性电极浸没在熔融氯化钠中。当电流通过电路时,阴极会富含电子并产生负电荷。带正电荷的钠离子被吸引到阴极,从而形成金属钠。同时,带正电荷的阳极吸引氯原子,形成氯气。最终生成金属钠、氯气和氢氧化钠水溶液。
电解池的应用
电解池有多种应用:
- 从水中制取氧气和氢气。
- 从铝土矿中提取铝。
- 电镀,即在另一种金属表面形成一层薄薄的特定金属保护层。
- 有色金属的电精炼。
- 电解回收工艺。
- 高纯度铜、高纯度锌和高纯度铝的工业生产几乎都是通过电解槽进行的。
![带阴极 HER 和阳极 ClER 的电解槽示意图]()
电解槽的应用(高纯锌、高纯铝、高纯铜)
电解槽在各种工业和工艺中发挥着至关重要的作用,使重要化学品和材料的生产成为可能。
电解的应用
电解在金属精炼或电镀的电沉积中的应用
电解广泛应用于金属精炼或电镀的电沉积工艺中。电解在这方面的一个实际应用是电清洗。在电解清洗中,需要清洗的物品(如锌或铝)被作为阴极,大电流通过电解质溶液。阴极会产生烧碱和氢气,从而有效去除物品表面的油脂和杂质。这种工艺可用于精炼或电镀金属,使金属表面光洁亮丽,防止腐蚀,并替代破旧的材料。
通过电解生产烧碱
电解法的另一个重要应用是大规模生产化学品,包括烧碱(NaOH)和氯气。在这一过程中,电解被用来将氯化钠(NaCl)分解成其组成元素钠(Na)和氯(Cl2)。阴极的反应是将钠离子 (Na+) 还原成金属钠 (Na),而阳极的反应是将氯离子 (Cl-) 氧化成氯气 (Cl2)。整个电池反应为 2NaCl → 2Na + Cl2。通过这种电解过程,可生产出大量烧碱和氯气,用于各种工业用途。
电解法提取金属
电解在从矿石中提取金属方面起着至关重要的作用。利用电解提取金属有两种主要方法。第一种方法是用强酸处理矿石以获得盐,然后电解盐溶液以提取金属。在第二种方法中,矿石处于熔融状态,直接在熔炉中进行电解。
利用电解提取金属的一个例子是提取锌。锌矿经硫酸处理后形成硫酸锌溶液,然后进行电解。电解槽中使用铝阴极和铅阳极。锌沉积在阴极上,而硫酸则在阳极上再生。这种电解过程可以提取出高纯度的锌。

锌和铝
总之,电解法在各行各业都有实际应用,包括金属的提取、提炼和电镀,以及烧碱等化学品的生产。利用电解的力量,企业可以获得高质量的结果,满足各自行业的需求。
将化学能转化为电能
在涉及产生能量的物质的反应中产生能量的解释
在电化学电池中,化学能通过电解过程转化为电能。电解是在电化学电池中发生的氧化还原反应,化学物质在电极上分解。电解的产物取决于电池中使用的电极和电解质的类型。这一过程是电化学各种应用的基础。
电化学领域涉及利用自发化学反应释放的能量产生电能,以及利用电能驱动非自发化学变化。氧化还原反应涉及物种之间的电子转移,是这些过程的核心。许多化学和生物反应都是氧化还原反应,它们在为家庭、交通或工业目的获取能源方面发挥着至关重要的作用。
这些反应产生的能量应用广泛,包括动物消化食物时燃烧燃料、工业过程、光合作用、从矿石中提取金属、制造重要的化学品以及操作电池和燃料电池。
铅酸蓄电池示例

铅酸电池
铅酸蓄电池既是电解池,也是电化池。放电时,它充当电解池,将化学能转化为电能。在放电过程中,二氧化铅、金属铅和硫酸会发生反应,生成硫酸铅和水。铅在一个电极上氧化成硫酸铅,而二氧化铅在另一个电极上还原成硫酸铅。电荷通过氢离子的迁移在电解质中传输。
氧化和还原过程的分离产生了驱动力或电压,使电流流过连接两个电极的外部电路。电池和电池中还使用了许多其他化学组合,每种化学组合都有其特定的反应和特性。
燃料电池
燃料电池是另一种将燃料的化学能转化为电能的电化学电池。这些电池通过氢燃料和氧化剂(通常是氧气)之间的电化学反应来工作。与电池不同,燃料电池需要持续不断的氧气和燃料供应才能产生电能。

燃料电池
总之,将化学能转化为电能是电化学中的一个基本过程。它是通过电化学电池(如铅酸蓄电池和燃料电池)中的氧化还原反应实现的。这些技术应用广泛,从为汽车提供动力到为太空探索发电。
用于发电的替代电池
- 了解太阳能电池以及半导体和光吸收的作用
- 非晶硅(A-Si)是一种主要的薄膜光伏材料,其光吸收率约为晶体硅的 40 倍。
- 碲化镉(CdTe)是另一种具有高光吸收率的薄膜材料。仅 1 毫米的薄膜就能吸收 90% 的太阳光谱。

非晶硅、碲化镉、二硒化铜铟
- 燃料电池及其氧化剂和还原剂的使用说明
- 燃料电池是一种电化学电池,能使氢燃料与氧气或其他氧化剂发生反应,从而将化学能转化为电能。
- 它们与电池不同,需要持续不断的燃料和氧气来维持化学反应。
- 只要有燃料和氧气供应,燃料电池就能持续发电。
- 燃料电池可用于商业、工业、住宅建筑和偏远地区等各种应用中的主电源和备用电源。
- 燃料电池还用于为叉车、汽车、公共汽车、船只、摩托车和潜艇等燃料电池车辆提供动力。
预计到 2030 年,全球燃料电池市场将增长 19.9%。
- 其他发电电池
- 太阳能电池通过半导体对光的吸收发电。
- 燃料电池利用燃料的化学能发电。
- 可充电电池通过充电可多次使用。
- 不可充电电池不能重复使用,需要丢弃。
- 铅酸电池/铅蓄电池是用作汽车动力源的二次电池。
薄膜电池,如薄膜太阳能电池、薄膜晶体管和薄膜电池,与传统电池相比,效率更高、充电更快、寿命更长。
用于发电的替代电池领域在不断发展。研究人员不断提高薄膜材料的效率和性能,而行业专家则致力于降低成本和扩大生产规模。如果您对该产品感兴趣,可以浏览我们公司的网站:https://kindle-tech.com/products/h-type-electrolytic-cell-h-type-triple

















