导言
电解槽 在铜纯化和电镀等各种工业流程中发挥着至关重要的作用。这些电池利用外部电源驱动化学反应,从而分解物质。在电解过程中,电流通过含有离子的液体或溶液,使其分解。在这篇博文中,我们将探讨电解池的概念、离子在其中的运动及其在铜生产中的应用。那么,就让我们深入了解电解槽的迷人世界吧!
电解池的定义
电解池是一种利用外部电源驱动非自发氧化还原反应的电化学电池。它通常用于电解等分解化合物的过程。电解池由两个电极组成,一个阳极(带正电的电极)和一个阴极(带负电的电极),分别浸入电解质溶液中。外部电能源(如电池)被施加在电极之间,迫使化学反应发生。这与电解池不同,后者本身就是一个电能源。
电解及其应用
电解是一种利用电解池和直流电推动不会自发发生的化学反应的技术。电解的一个重要应用是将水分解成氢气和氧气。这一过程用于生产氢气,氢气可用作清洁的可再生能源。另一个重要应用是电解铝土矿以获得铝和其他化学品。
电镀是电解的另一种常见应用。它是利用电解池在表面沉积一层金属。铜、银、镍和铬是可以电镀到各种物体上的部分金属。
电化学电池和氧化还原反应
电化学电池是一种利用自发氧化还原反应产生电能或利用电能驱动非自发反应的装置。电化学电池的工作原理是研究电与化学反应之间的关系。
在氧化还原反应中,电子从一种物质转移到另一种物质。如果反应是自发的,则会释放出能量,可用于做有用功。相反,非自发反应则需要输入能量才能发生。电化学电池可通过化学反应产生电能或利用电能驱动反应,从而促进这些反应的发生。
电解池的组件
电解池的主要组成部分是阴极、阳极和电解液。阴极是带负电的电极,而阳极是带正电的电极。电解质是阴极和阳极之间交换电子的介质。
电解池中常用的电解质包括含有溶解离子的水和熔融氯化钠。电解池中的电子流克服了非自发氧化还原反应的活化能障,使所需的化学变化得以发生。
结论
总之,电解池是一种利用电能驱动非自发氧化还原反应的电化学装置。它常用于电解和电镀等过程。了解电化学原理和电解池的组件对于将这些电解池用于各种应用至关重要。
电解的概念
电解是指电流通过含有离子的液体或溶液,导致物质分解的过程。
电解产物
电解是利用电流分解化合物,通常是熔融状态或水溶液中的离子化合物。电解产物可以是原子、分子、离子或气体。所用电极和电解质的类型决定了电解过程的具体产物。
在电解过程中,电极在通过电子运动将电传入或传出电池方面起着至关重要的作用。电极有两种类型:
-
阳极:正极称为阳极。带负电荷的离子向阳极移动,氧化作用在阳极发生。
-
阴极:负极称为阴极。带正电的离子向阴极移动,在阴极发生还原反应。
电解中的电极
在电解过程中,电流进出电解质溶液,以恢复非自发反应所需的离子流。在此过程中,电极要在一定距离内浸入和分离。由电源提供的电流通过电解质,完成电路。
直流电用于驱动电解反应。电流使电解质中的离子被吸引到带相反电荷的电极(阴极和阳极)上。所需的电能等于反应的吉布斯自由能变化以及系统中的任何损耗。
电解过程
电解过程需要使用电解池,电解池由分开的正负极组成,正负极浸入含有正负离子的溶液中。要转化的物质可以形成电极、构成溶液或溶解在溶液中。
带负电的电极称为阴极,是电流的入口。溶液中的成分迁移到阴极,与电子结合并发生还原,从而形成中性元素或新分子。
相反,溶液中的成分也会向带正电的电极(阳极)移动。在阳极,这些成分释放出电子并发生氧化,从而形成中性元素或新分子。
如果要转化的物质是电极本身,则反应通常涉及电极在放弃电子时的溶解。
电解是化学中的一个基本过程,通过施加电流实现物质的分解和转化。它在发现和了解现代化学中的各种元素方面发挥了重要作用。
直流电源在电解池中的作用
电解池
要了解直流电源在电解池中的作用,我们首先需要掌握电解的概念。电解是指电流通过含有离子的液体,使液体中的化合物分解的过程。这种方法通常用于从金属化合物中分离金属、分离其他化学物质、电镀金属和给电池充电。
要进行电解,必须有一个完整的电路从电池中持续汲取电能。电解池由两个稳定的电极(阴极和阳极)组成,它们与电源相连。这些电极和流体电解质溶液是每个电解池的重要组成部分。电解质溶液导电是因为溶解的离子可以在溶液中自由移动。

定义:电解
电解是指电流通过含有离子的液体或溶液,使其中的物质发生分解的过程。
为了维持电解反应,需要一个完整的电路,从电池或电源中持续获取电能。这就要求离子能够在电解质中自由移动。
在电解池中,使用的是直流电源,这意味着电极始终为正极或负极。这种极性对于电解过程的有效进行至关重要。
电解质是指能导电并能进行电解的物质或混合物。
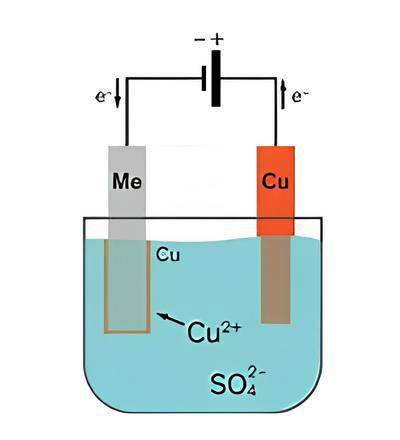
当直流电通过电解池中的电解质时,就会发生电解。在铜提纯过程中,阳极的不纯铜被氧化,形成 Cu2+ 离子。在阴极电极上,正的铜离子发生还原,生成纯金属铜。其他金属形式的杂质不会溶解,而是在容器底部形成固体淤泥。
电化学电池的类型
电化学电池可分为三种类型:充电电池、非充电电池和燃料电池。
燃料电池需要外部供应燃料,作为发电所需的化学能来源。另一方面,可充电和不可充电电池的燃料储存在电池内部。
了解直流电源在电解槽中的作用,对于在金属提纯和电镀等各种工业流程中利用电解能量至关重要。通过利用直流电源,电解槽可以分解物质并生成纯净的元素物质或其他化学品。
电解质的定义
电解质是一种含有可进行电解的流动离子的物质或混合物。这意味着,当电流通过电解质时,其中的物质会发生化学变化。电解质可以盐溶液或熔盐的形式存在。

阳极和阴极
在电解中,阳极和阴极指的是过程中涉及的电极。阳极是电子流出的电极,而阴极是电子流向的电极。在电解池中,阳极是正极。
电解质的导电性
电解质能够导电是因为它们含有可以自由移动的离子。通电时,电解质中的阴离子向阳极移动并被氧化,而阳离子则向阴极移动并被还原。离子的这种移动使电荷在电解质中流动。
电解质类型
电解质主要有两种:强电解质和弱电解质。强电解质溶解在溶液中会完全解离成离子,而弱电解质只能部分解离成离子。
强电解质的例子包括可溶性盐、酸和碱。这些物质可以让电流在电池或电解池的阳极和阴极之间流动。另一方面,弱电解质在溶液中不会完全离解成离子。

电化学电池
电化学电池是一种将电能转化为化学能的装置,反之亦然。它由电解液、盐桥和电极组成。电池中的电解质是使电流在阳极和阴极之间流动的物质。电解质可以是液体或固体。
在电化学电池中,电流以离子而非电子的形式流过电解质。带负电荷的离子(称为阴离子)从阴极流向阳极,而带正电荷的离子(称为阳离子)则从阳极流向阴极。离子的这种双向流动使电荷得以在电解质中转移。
电解
电解是指电流通过物质以引起化学变化的过程。电解通常在电解池中进行,电解池由浸入含有正负离子溶液中的正负电极组成。
在电解过程中,电子通过阴极进入,使溶液中的成分与电子结合并发生还原。同时,溶液中的成分到达阳极,放弃电子,发生氧化反应。这些反应的产物可以是中性元素或新分子。
在某些情况下,待转化的物质可能形成电极、构成溶液或溶解在溶液中。无论具体设置如何,电解都可以通过施加电流来控制化学反应。
电解池中阳极和阴极的作用

阳极:向外部电路提供电子的电极
电解池中的阳极在电化学过程中起着至关重要的作用。它是发生氧化的电极,这意味着电子从阳极流出,进入外电路。电子的流动使得电荷得以转移,电池内的电路得以完成。
在电解池中,阳极带正电。它是阴极发生还原反应所需的电子源。阳极通常由铜、银或金等活性材料制成,可在电解液中解离并促进离子流动。
阴极:接受外电路电子的电极
另一方面,阴极是电解池中接受外电路电子的电极。它是发生还原反应的负极。从外电路流入阴极的电子与电池中的氧化剂结合,导致氧化剂还原。
阴极对电解池的整体功能至关重要。它是发生所需化学反应的场所,从而产生所需产物。在电解过程中,阴极带负电荷,以吸引带正电荷的阳离子。阳离子到达阴极后,可以通过获得电子而被还原,从而形成所需的产物。
阳极和阴极都是电解池的重要组成部分,存在于电池、燃料电池、光伏电池、电解池和二极管等各种电气设备中。电解质是电子在阴极和阳极之间流动的通道,在促进电化学反应方面发挥着重要作用。
了解电解池中阳极和阴极的作用对于理解这些设备的工作原理至关重要。阳极能促进氧化反应,而阴极则能促进还原反应,从而实现所需的化学转化。利用电解的力量,可以高效地实现各种应用,如生产纯铜。
电解池中的离子运动
阳离子:向阴极移动并被还原
阴极是电解池中的正极。它是发生还原反应的地方。阳离子是带正电的离子,向阴极移动并被还原。这意味着它们在阴极获得电子。这种还原反应在各种工业流程中至关重要,例如生产高纯度铜和其他金属(如钠、镁和铝)。在这些过程中,阳离子通过电解产生所需的金属。
阴离子向阳极移动并被氧化
阳极是电解池中的负极。它是发生氧化反应的地方。阴离子是带负电荷的离子,向阳极移动并被氧化。这意味着它们在阳极失去电子。阴离子的氧化可导致氧气等气体的释放或某些元素的沉积。例如,在电解铜盐和银盐时,阳离子在阴极被还原,而在电解钾盐、钠盐和钙盐时,由于水被还原,会释放出氢气。

总之,在电解池中,阳离子向阴极移动并被还原,而阴离子向阳极移动并被氧化。离子的这种移动对电解池中发生的各种电化学过程至关重要。
阴极
阴极是电解池中的正极,在发生的还原反应中起着至关重要的作用。电子从电路流入电池的非金属部分。在阴极,阳离子吸收来自连接阴极的导线的电子,从而发生还原反应。这种还原反应在生产高纯度铜和其他金属等过程中非常重要。
电解
电解是发生在电解池中的过程,电解池利用电能进行非自发的化学反应。在电解过程中,阳极(即正极板)发生氧化反应,而阴极(即负极板)发生还原反应。电解池通过这些氧化还原反应将电能转化为化学能。
电解池内的传导
在电解池中,当电子移动时,电流会通过外部电路,但在电解池内部则会发生不同的过程。电解质中的正离子在阴极获得电子并发生还原反应,而负离子则迁移到正极(阳极)释放电子并发生氧化反应。离子和电子在电池内的这种移动就是电解过程的发生方式。
电解质的类型
电解质可分为强电解质和弱电解质,这取决于它们在水溶液中的电离程度。强电解质电离程度高,传导电流强;弱电解质电离程度低,传导电流小。
阳极
阳极是常规电流进入电化学电池的电极。它是发生氧化反应的场所。负离子或阴离子容易发生反应,并因其电势而在阳极放出电子。电子随后在电路中移动。在电解池中,阳极为负极,电子主要向电路外侧移动。
电极示例
电极分为两种:活性电极和惰性电极。活性电极参与电池中发生的反应,并能在电解液中解离。活性电极的例子包括铜、银和金。
总之,了解电解池中离子的运动对于理解电解池中发生的电化学过程至关重要。阳离子向阴极移动并被还原,而阴离子向阳极移动并被氧化。离子的这种移动和随之而来的电子流是电解的基础,在电解过程中,电能被用来驱动非自发的化学反应。
电解在铜生产中的应用
提取金属
电解法广泛应用于金属提取。利用电解提取金属有两种方法:

-
锌的提取:在这一过程中,锌矿石经硫酸处理后得到硫酸锌溶液。然后在一个装有铝阴极和铅阳极的槽中对溶液进行电解。电流密度保持在 1000 A/m2 ,锌沉积在阴极上。该工艺的能耗约为每吨 3000 至 5000 千瓦时。
-
铝的提取:铝土矿和冰晶石等铝矿经化学处理后还原成氧化铝。然后将氧化铝溶解在熔融冰晶石中,在熔炉中进行电解。铝在阴极沉积,在底部沉淀。熔炉的温度保持在 1000°C 左右,需要约 4000 安培的电流。该工艺消耗的能源约为每吨 20,000 至 25,000 千瓦时。
精炼金属
电解也可用于提炼金属。使用电解工艺提炼金属的主要优点是获得的产品纯度高(约 98%至 99%),并且能够进一步提炼金属。在精炼过程中,阳极由提取的金属制成,纯金属沉积在阴极。所使用的电解液由金属溶液制成,例如炼铜使用硫酸铜,炼镍使用氯化镍。电解法炼铜的能耗约为每吨精炼铜 150 至 300 千瓦时。
总之,电解在金属的提取和精炼过程中发挥着至关重要的作用,可确保最终产品的高纯度和高质量。
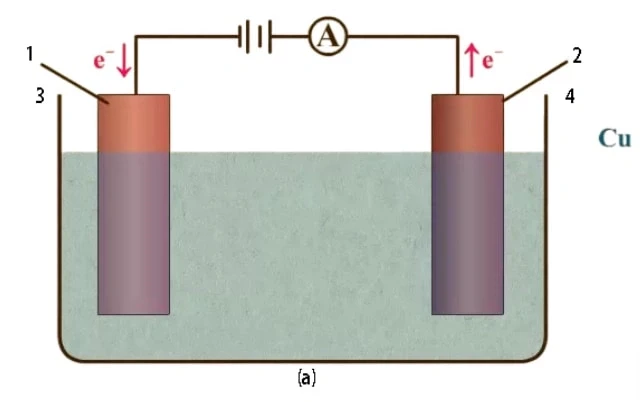
电解提纯铜的过程
将不纯的铜板放入硫酸铜(II)溶液槽中
在电解法提纯铜的过程中,首先要从铜矿提取不纯的铜板。然而,这些不纯铜板的纯度不足以用于电子产品和其他关键应用。为了获得更纯净的铜板,需要使用电解法。
将不纯的铜板放入硫酸铜(II)溶液槽中。这种溶液在电解过程中充当电解液。不纯铜板连接到外部电源的正极,而纯铜板则连接到电源的负极。
外部电源驱动阴极镀铜的反应
外部电源驱动电解过程中的两个反应。在阳极(不纯铜板),铜被氧化并以 Cu2+ 离子的形式溶解到电解液中:
Cu(s) ⇒ Cu2+(aq) + 2e-
这一氧化反应会使不纯的阳极铜溶解到电解液中,从而导致质量下降。
在阴极(纯铜板),电解液中的铜离子通过获得电子被还原,形成金属铜:
Cu2+ (aq) + 2e- ⇒ Cu(s)
这种还原反应使金属铜镀到阴极上,从而使阴极的质量增加。
不纯铜板中的杂质会留在电解液中。可溶性杂质留在电解液中,而不溶性杂质要么留在阳极中,要么掉落到反应容器底部。
电解过程广泛应用于纯铜的生产。铜是一种高导电性金属,可用于电路、电线、管道和冷却装置等多种用途。铜还以其延展性和延展性著称。
电解在铜生产的最后提纯步骤中起着至关重要的作用。通过使用以硫酸铜(II)溶液为电解液的电解槽,可将不纯的铜板转化为高纯度铜板。这一工艺可确保铜板达到预期应用所需的纯度标准。
总之,电解是冶金学中的一种重要方法,可将不纯铜转化为高纯度铜。它还可用于提取和提炼钠、镁和铝等其他金属。电解是一种多功能工艺,可以大规模生产纯金属。
铜提纯工艺的最终结果
不纯铜阳极失去质量

在铜精炼过程中,不纯的阳极铜会发生氧化并失去质量。阳极中的铜原子以 Cu2+ 离子的形式溶解到电解质溶液中。
纯阴极铜质量增加
同时,纯铜被镀到阴极上。电解质溶液中的铜离子在阴极被还原,从而沉积出纯铜金属。因此,在整个纯化过程中,纯铜阴极的质量都会增加。
可溶性杂质残留在电解液中
在纯化过程中,不纯铜阳极中的可溶性杂质不会沉积到阴极上。相反,它们会留在电解质溶液中。这样,杂质就能从纯化的铜中分离出来。
不溶性杂质留在阳极或掉落到反应容器底部
不溶性杂质,如其他金属或固体颗粒,要么留在不纯铜阳极中,要么掉落到反应容器底部。这些杂质不会溶解到电解质溶液中,而是与纯化铜物理分离。
纯化过程涉及电解,即利用电能驱动化学反应。不纯铜阳极是铜离子的来源,而纯铜阴极则是铜沉积的场所。通过仔细控制工艺,杂质被去除,从而得到高纯度的铜。
值得注意的是,净化过程中使用的电解质(如硫酸铜)在促进离子移动和分离杂质方面起着至关重要的作用。此外,电解过程中使用的温度和电流也会影响净化过程的效率。
总体而言,铜提纯过程的最终结果包括不纯铜阳极的质量损失、纯铜阴极的质量增加、电解液中可溶性杂质的保留以及阳极或反应容器底部不溶性杂质的分离。这些结果导致了高纯度铜的生产,使电解提纯成为冶金工业中必不可少的方法。
结论
总而言之电解槽 在铜提纯和电镀中发挥着至关重要的作用。通过使用外部电源驱动反应,电解可以分解含有离子的液体或溶液中的物质。阳极向外部电路提供电子,而阴极则接受电子。阳离子向阴极移动并被还原,而阴离子向阳极移动并被氧化。在铜纯化过程中,将不纯的铜板浸入硫酸铜溶液中,然后在阴极镀上纯铜。其结果是减少阳极中的杂质,生产出高质量的铜。