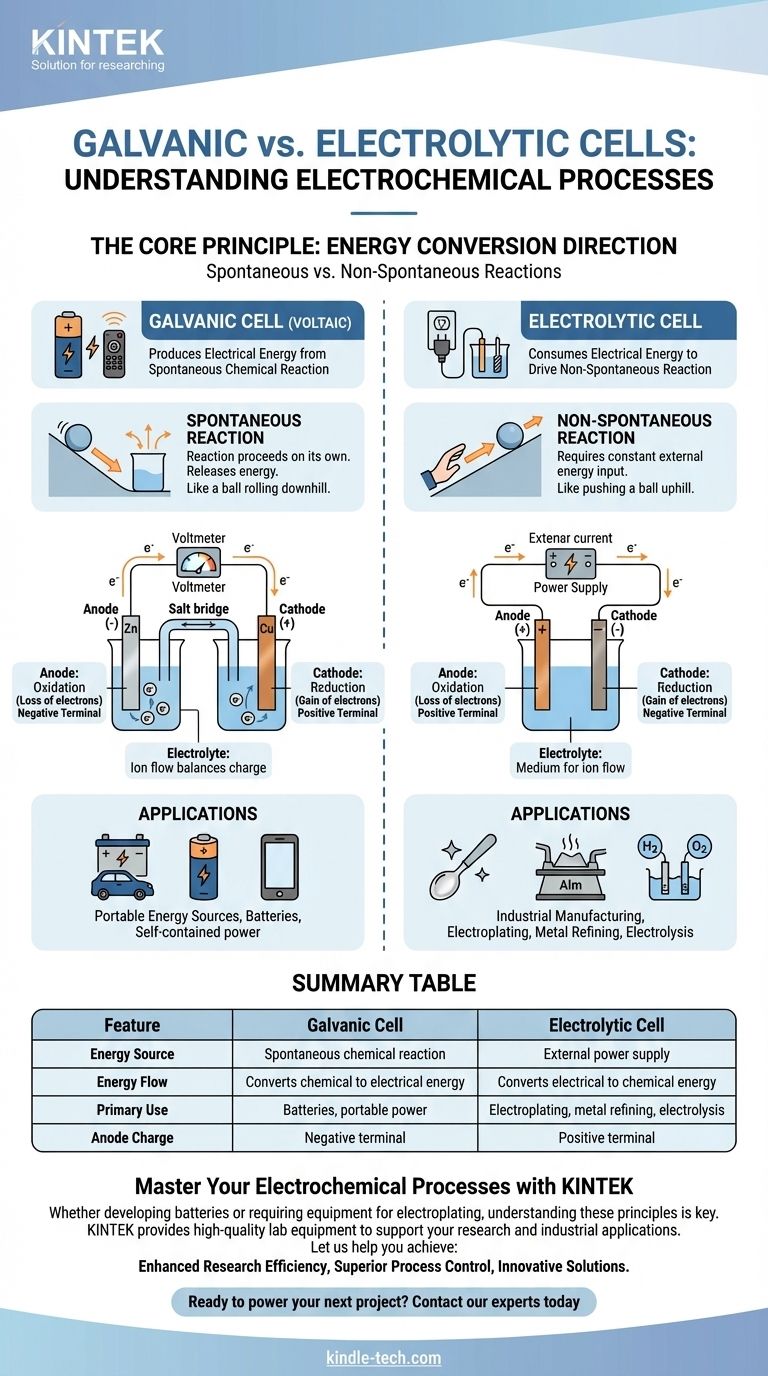
从本质上讲,原电池是一种电化学电池,它通过自发的化学反应产生电能,就像为遥控器供电的电池一样。相反,电解池则从外部电源消耗电能,以迫使一个非自发的化学反应发生,这一过程被用于金属电镀和提纯。
根本的区别在于能量转换的方向。原电池将储存的化学能转化为电能,而电解池将外部电能转化为化学能。
核心原理:自发反应与非自发反应
任何电化学电池的行为都取决于其化学反应的自然倾向。这种倾向是理解一个电池为何能发电而另一个需要用电的关键。
原电池如何发电
原电池,也称为伏打电池,是围绕着一个自发化学反应构建的。
这是一个无需外部干预即可自行发生的反应,在此过程中释放能量。可以将其视为一个球从山坡上滚下来。
这种能量的释放将电子通过外部电路推动,从而产生电流。这是所有不可充电电池和放电中的可充电电池背后的原理。
电解池如何耗电
电解池驱动一个非自发化学反应。
这是一个不会自行发生的反应,需要持续输入能量才能进行。这相当于将球推上山坡。
外部电源(如电源)提供必要的电压,迫使电子逆着它们的自然方向流动,从而驱动所需的化学变化。

实际观察电池功能
尽管它们的目的相反,但两种电池都共享在相同基本化学规则下运行的常见组件,但在极性上存在关键差异。
阳极和阴极:极性之争
在两种电池类型中,阳极始终是发生氧化(电子损失)的地方,而阴极始终是发生还原(电子获取)的地方。
然而,它们的电荷是相反的。在原电池中,阳极是负极,因为自发反应从它那里释放电子。
在电解池中,阳极是正极,因为外部电源将电子从它那里拉走,迫使氧化发生。
电解质的作用
两种电池都含有一种电解质,通常是含有离子的溶液。
这种介质对于完成电路至关重要。虽然电子通过外部导线流动,但离子通过电解质流动以平衡电极处的电荷。
理解应用和权衡
这些电池相反的功能带来了截然不同的现实世界应用和固有局限性。
原电池:便携式能源
原电池的主要用途是充当电池。它们提供了一种便携、独立的电能来源。
权衡之处在于电池内的化学反应物是有限的。一旦它们被消耗,电池就会停止供电,必须被丢弃或充电。
电解池:工业制造和提纯
电解池是工业的“主力军”,用于那些在化学上否则不可能或效率低下的过程。
主要应用包括电镀(用另一种金属涂覆金属)、提炼铝和铜等金属,以及水的电解以产生氢气和氧气。它们的主要限制是对大量持续的外部电能供应的需求。
如何应用这些知识
您对这些概念的选择完全取决于您的目标是发电还是诱导化学变化。
- 如果您的主要重点是从化学反应中发电: 您正在研究原电池的原理,例如在设计或理解电池时。
- 如果您的主要重点是利用电能来制造产品或提纯物质: 您正在研究电解池的原理,这在化学制造和冶金学中很常见。
理解这种划分是掌握电化学实际应用的第一步。
总结表:
| 特征 | 原电池 | 电解池 |
|---|---|---|
| 能量来源 | 自发化学反应 | 外部电源 |
| 能量流向 | 化学能转化为电能 | 电能转化为化学能 |
| 主要用途 | 电池、便携式电源 | 电镀、金属提纯、电解 |
| 阳极电荷 | 负极 | 正极 |
利用 KINTEK 掌握您的电化学过程
无论您是开发新型电池技术,还是需要用于电镀和金属提纯的精密设备,了解这些核心电化学原理仅仅是开始。KINTEK 专注于提供高质量的实验室设备和耗材,以支持您的研究和工业应用。
让我们帮助您实现:
- 提高研究效率: 提供可靠的设备来测试和开发原电池和电解池系统。
- 卓越的过程控制: 确保在电镀、电解和材料合成中获得一致的结果。
- 创新解决方案: 根据实验室和生产设施的独特需求量身定制。
准备好为您的下一个项目提供动力了吗? 立即联系我们的专家,为您的实验室需求找到完美的解决方案!
图解指南