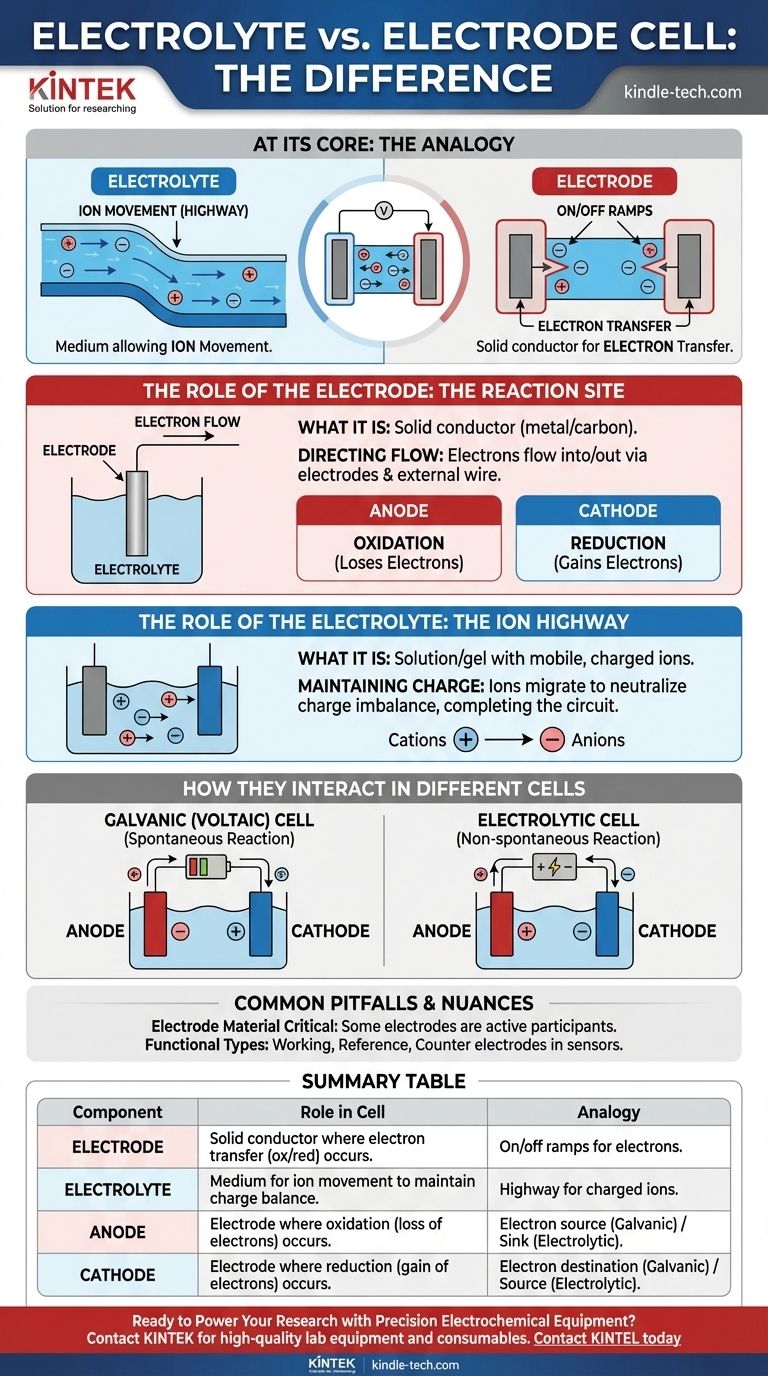
核心区别在于,电解质是允许离子移动的介质,而电极是发生化学反应和电子转移的物理导体。电解质是电池内部带电离子的“高速公路”,而电极是连接这条高速公路与外部电路的“匝道”。
在任何电化学电池中,电极是发生化学反应的固体导体,这些反应会释放或消耗电子。电解质是必需的液体或凝胶介质,用于在这些电极之间传输离子,从而完成电路。
电极的作用:反应位点
电极充当电池内部化学组分与外部电子电路之间的物理界面。
什么是电极
电极是一种固体导电体,通常是金属或碳,置于电解质中。它的作用是向溶液中的物质传输电子或从溶液中的物质接收电子。
引导电子流
电子不能穿过电解质。相反,它们通过电极和连接的外部导线流入或流出电池。
阳极与阴极
所有电池都有两种类型的电极,根据其表面发生的反应来定义:
- 阳极是发生氧化反应(物质失去电子)的地方。
- 阴极是发生还原反应(物质获得电子)的地方。

电解质的作用:离子高速公路
电解质与电极同样重要。没有它,电路就不完整,电流也无法流动。
什么是电解质
电解质是一种物质,通常是含有盐、酸或碱的溶液,溶解后会产生导电溶液。它含有可移动的带电离子。
维持电荷中性
当电子在阳极释放并在阴极消耗时,电荷不平衡会迅速累积并阻止反应。电解质通过允许其离子在电极之间迁移来防止这种情况,从而中和电荷并使过程继续进行。
它们在不同电池中的相互作用
阳极和阴极的具体电荷取决于电池是产生还是消耗电能。
在原电池(伏打电池)中
这些电池,如普通电池,通过自发反应将化学能转化为电能。
- 阳极带负电,因为它是外部电路的电子源。
- 阴极带正电,因为它是电子返回电池的地方。
在电解池中
这些电池利用外部电能驱动非自发反应,例如电镀或水电解。
- 阳极带正电,因为它连接到外部电源的正极端子以拉走电子。
- 阴极带负电,因为它连接到负极端子以强制电子进入。
常见陷阱和细微之处
理解基本定义是第一步。认识到细微之处才能真正理解。
电极材料至关重要
电极并非总是惰性导体。在许多电池中,电极材料本身是化学反应的积极参与者,例如碱性电池的锌外壳充当阳极。
功能性电极类型
在分析化学和传感器应用中,电极根据其功能被赋予更具体的名称。
- 工作电极是发生目标化学反应的地方。
- 参比电极提供稳定的恒定电位以进行测量。
- 对电极完成电路,将电流传递给工作电极。
根据您的目标进行正确区分
要应用这些知识,请关注每个组件在您的特定上下文中扮演的基本角色。
- 如果您的主要关注点是基础电池科学:将电极视为电子得失(阳极/阴极)的场所,将电解质视为维持电池运行的必需离子移动器。
- 如果您的主要关注点是进行电解:请记住,电极的极性(+/-)与电池相反,但它们的根本化学作用(阳极=氧化,阴极=还原)保持完全相同。
- 如果您的主要关注点是构建电化学传感器:您必须区分工作电极(事件发生的地方)、参比电极(用于稳定测量)和对电极(完成电路)。
最终,电极和电解质是两个截然不同但密不可分的组件,它们构成了所有电化学技术的基础。
总结表:
| 组件 | 在电化学电池中的作用 | 类比 |
|---|---|---|
| 电极 | 发生电子转移(氧化/还原)的固体导体。 | 连接外部电路的电子匝道。 |
| 电解质 | 允许离子移动以维持电荷平衡的介质(液体/凝胶)。 | 电池内部带电离子的高速公路。 |
| 阳极 | 发生氧化(失去电子)的电极。 | 电子源(原电池)或电子汇(电解池)。 |
| 阴极 | 发生还原(获得电子)的电极。 | 电子目的地(原电池)或电子源(电解池)。 |
准备好使用精密电化学设备为您的研究提供动力了吗?
理解基础知识是第一步。使用正确的工具应用它们是推动发现的关键。无论您是开发新型电池材料、进行精确电解,还是构建灵敏传感器,KINTEK都能提供您所需的高质量实验室设备和耗材。
我们专注于满足实验室的精确需求。让我们帮助您选择完美的电化学电池、电极和电解质,以确保您的特定应用获得准确可靠的结果。
立即联系 KINTEL 讨论您的项目需求,并了解我们的解决方案如何提升您实验室的能力!
图解指南