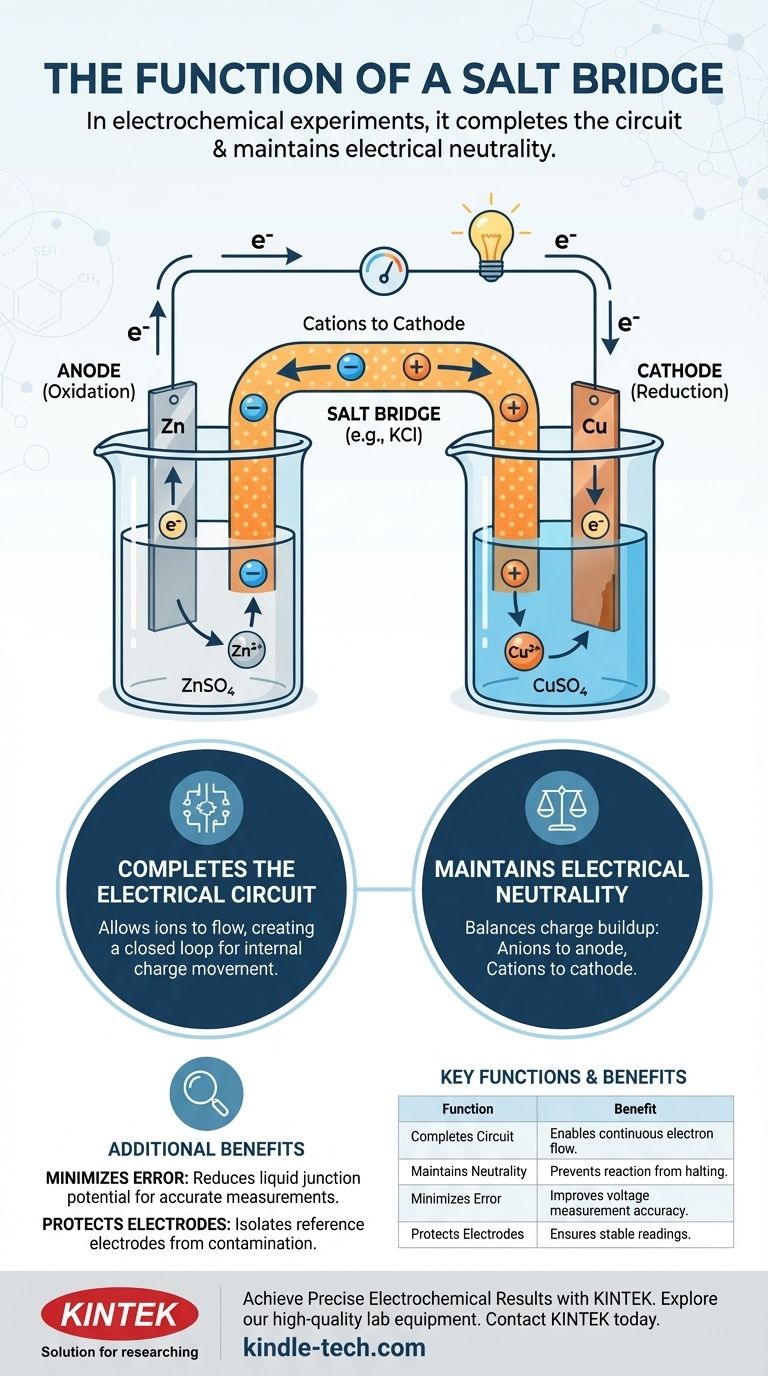
在电化学实验中,盐桥有两个主要功能:它通过允许离子在两个半电池之间流动来完成电路,并维持每个半电池的电中性。如果没有这个关键组件,电荷会迅速积累,几乎立即停止电子的流动并停止电化学反应。
盐桥不仅仅是一个连接器;它是使持续的电化学反应成为可能的电荷平衡机制。它在内部工作,移动离子以抵消电子在外部移动所产生的电荷不平衡。
电化学电池的结构
要理解盐桥的功能,您必须首先想象它所处的系统。电化学电池从根本上说是一种将化学能转化为电能或反之的装置。
两个半电池
电化学电池由两个半电池组成。每个半电池通常包含一个电极(如锌或铜的固体导体),浸没在电解质溶液(含有离子的溶液,如硫酸锌或硫酸铜)中。
在一个半电池中发生氧化(电子的损失),该电极被称为阳极。在另一个半电池中发生还原(电子的获得),该电极被称为阴极。
问题:瞬时电荷积累
在阳极产生的电子通过外部导线传输到阴极,产生电流。然而,这种电子流动会产生一个直接的问题。
当阳极失去电子时,其电解质溶液会积累过量的正离子。相反,当阴极获得电子时,其电解质溶液会产生过量的负离子(因为溶液中的正离子被消耗了)。这种电荷分离会产生强大的反向电压,使电子流动完全停止。

盐桥的核心功能
盐桥是解决这种电荷积累问题的巧妙方法。它通常是一个U形管,装满了惰性电解质(如氯化钾 (KCl) 或硝酸钾 (KNO₃))的浓溶液。
完成电路
一个完整的电路需要一个闭合回路。外部导线允许电子流动,但这只是电路的一半。盐桥通过允许离子在半电池之间流动来完成回路,为电荷在内部移动创造了一条路径。
维持电中性
这是盐桥最关键的功能。为了中和积累的电荷:
- 盐桥中的阴离子(负离子)迁移到阳极半电池,以平衡正在产生的过量正离子。
- 盐桥中的阳离子(正离子)迁移到阴极半电池,以平衡过量的负电荷。
通过不断平衡两个半电池中的电荷,盐桥确保电化学反应能够进行并维持稳定的电流。
最小化液接电位
在更精确的测量中,盐桥还有助于减少液接电位。这是在两种不同电解质溶液的界面处形成的一个微小、不希望的电压。通过创建更平缓的离子桥,它最大限度地减少了这种误差源,从而实现了对电池电位的更准确测量。
了解实际考虑因素
盐桥的有效性完全取决于其组成以及与电池其余部分之间的相互作用。
电解质必须是惰性的
盐桥中的离子不得与任一半电池溶液中的离子发生反应。例如,在含有硝酸银 (AgNO₃) 的电池中使用 KCl 盐桥将是一个错误。氯离子 (Cl⁻) 会与银离子 (Ag⁺) 反应生成固体沉淀 (AgCl),从而破坏电池的功能。
保护参比电极
在电化学中常见的三电极设置中,盐桥通常用于将参比电极(具有恒定、已知电位的电极)连接到主体溶液。这样做是为了隔离参比电极,防止测试溶液中的离子污染它并改变其稳定的电位。这延长了电极的使用寿命并确保了测量的准确性。
为您的实验做出正确的选择
盐桥的主要作用始终是促进离子流动,但根据您的目标,可以通过不同的角度来看待其重要性。
- 如果您的主要重点是简单的原电池演示: 将盐桥视为完成电路并使电池持续运行的组件。
- 如果您的主要重点是精确的电压测量: 盐桥对于最小化液接电位至关重要,这是实验误差的一个关键来源。
- 如果您的主要重点是分析电化学(例如腐蚀研究): 盐桥对于隔离您的参比电极至关重要,以确保您对电位读数有一个稳定、可靠的基线。
最终,盐桥通过解决电荷分离的基本问题,使得对电化学反应的受控和连续研究成为可能。
总结表:
| 功能 | 描述 | 关键益处 |
|---|---|---|
| 完成电路 | 允许离子在半电池之间流动。 | 实现连续的电子流动。 |
| 维持中性 | 平衡由电子转移引起的电荷积累。 | 防止反应停止。 |
| 最小化误差 | 减少液接电位。 | 提高电压测量的准确性。 |
| 保护电极 | 将参比电极与污染物隔离。 | 确保读数稳定可靠。 |
准备在您的电化学实验中获得精确可靠的结果吗?正确的设备是您成功的根本。KINTEK 专注于高质量的实验室设备和耗材,包括专为准确性和耐用性设计的电化学电池和配件。让我们与我们的专家一起,根据您的研究需求选择最完美的设置。
立即联系 KINTEK,讨论我们如何支持您实验室的电化学能力!
图解指南