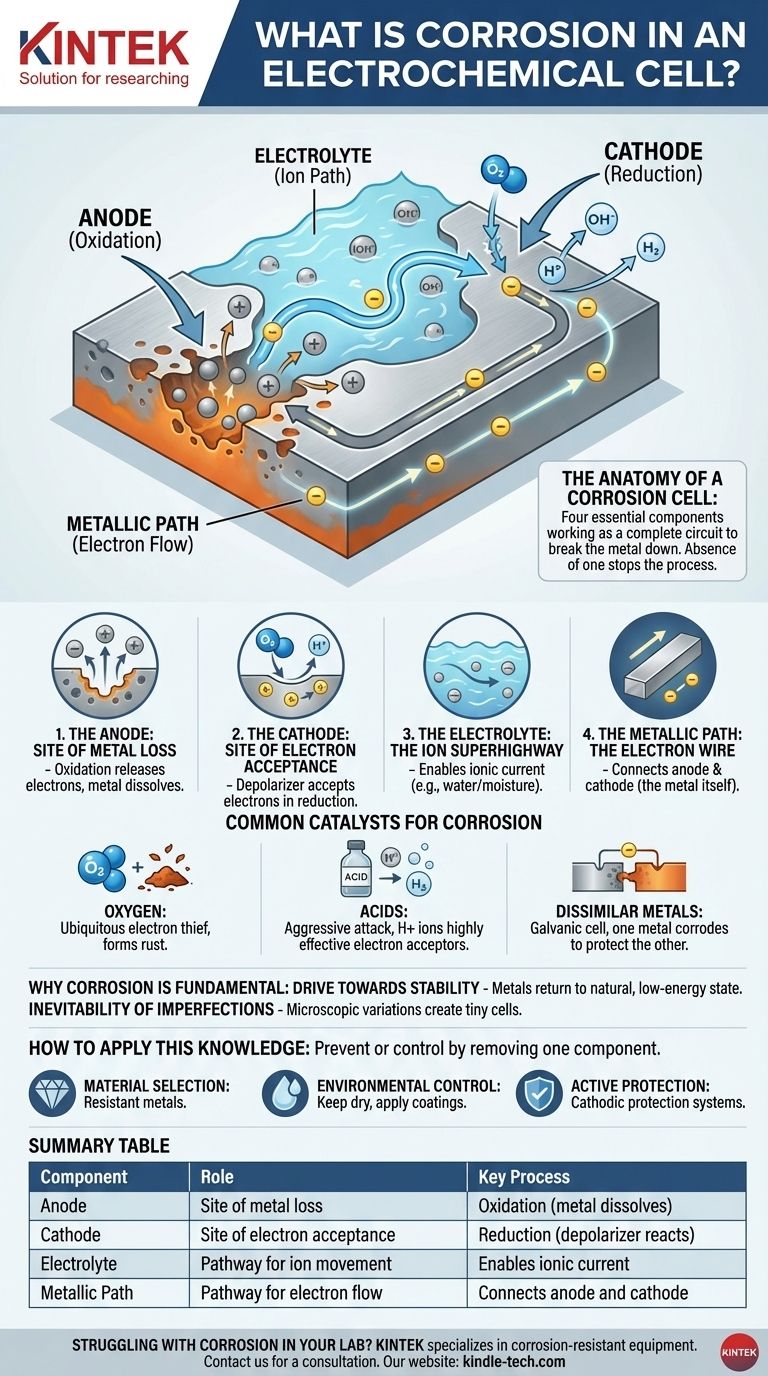
从本质上讲,腐蚀是精炼金属自然降解成更化学稳定的形式,例如其氧化物或硫化物。在电化学电池中,这个过程不仅仅是表面反应,而是一个完整的回路,金属通过在其自身表面形成一个微小的、不需要的电池来本质上自我破坏。
腐蚀是一个电化学过程,因为它涉及电池的四个基本组成部分:阳极(金属在此处流失)、阴极、电解质(如水)和金属路径,它们共同作用以分解金属。
腐蚀电池的解剖
理解腐蚀就是理解其运作所需的四个组成部分。缺少其中任何一个组成部分都将完全停止这个过程。
阳极:金属流失的部位
阳极部位是金属表面发生腐蚀的特定点。在这里,金属原子发生氧化,失去电子并转化为带正电的离子,溶解到周围的水或湿气中。这是金属被腐蚀的物理行为。
阴极:电子接受的部位
从阳极释放的电子通过金属移动到另一个位置,即阴极部位。在这里,环境中的一种物质——称为去极化剂——通过还原反应接受这些电子。这种去极化剂是一个关键成分。
电解质:离子高速公路
水,即使是微量的,如湿度,也充当电解质。它为溶解的金属离子(来自阳极)和其他离子提供了一个移动介质,从而完成电路。没有电解质,离子无法移动,电路就会断开。
金属路径:电子导线
金属本体充当金属路径。它为电子从阳极流向阴极提供了导电通路。这就是为什么阳极和阴极部位可以紧密相邻,也可以在同一块金属上相距很远。
常见的腐蚀催化剂
腐蚀的速率和严重程度通常取决于阴极处去极化剂(电子受体)的可用性和类型。
氧气:无处不在的电子窃贼
在大多数常见环境中,溶解的氧气是主要的电子受体。这就是为什么水和氧气共同对铁等金属具有如此大的破坏性,导致铁锈(氧化铁)的形成。
酸:侵蚀性攻击
酸会显著加速腐蚀。酸溶液中的氢离子(H+)是非常有效的电子受体,在阴极产生氢气。这个过程通常比氧气驱动的腐蚀更快、更具侵蚀性。
异种金属:原电池
当两种不同的金属在电解质中电接触时,它们会形成一个原电池。较不贵重、更活泼的金属将成为阳极并迅速腐蚀,而较贵重的金属则成为阴极并受到保护。这就是为什么您会在船体上看到牺牲锌阳极来保护钢材。
为什么腐蚀是一个基本过程
腐蚀不是缺陷;它是一个由热力学基本定律驱动的自然而自发的过程。理解这种必然性是管理它的关键。
趋向稳定
铝和钢等精炼金属是人造材料,处于高能状态。腐蚀只是金属返回其自然、低能状态的过程,类似于从中提取的矿石。金属正在释放其储存的能量。
不可避免的缺陷
没有金属表面是完全均匀的。成分的微小变化、制造过程中的应力,甚至氧气暴露的差异,都会在整个表面上产生微小的阳极和阴极部位。这些缺陷足以引发数千个微观腐蚀电池。
如何应用这些知识
了解腐蚀是一个电化学电池,为您提供了预防或控制它的清晰框架。策略始终是移除四个基本组成部分之一。
- 如果您的主要重点是材料选择:使用在工作环境中天然抗形成电化学电池的金属,或避免连接异种金属。
- 如果您的主要重点是环境控制:通过保持金属干燥或涂覆防水涂层(如油漆)来阻止水分到达表面,从而消除电解质。
- 如果您的主要重点是主动保护:有意创建一个更强大的电化学电池,使您的结构金属被迫成为阴极。这是牺牲阳极和阴极保护系统背后的原理。
通过将腐蚀视为一个简单的电路,您可以系统地诊断其原因并有效中断其破坏性路径。

总结表:
| 组成部分 | 在腐蚀电池中的作用 | 关键过程 |
|---|---|---|
| 阳极 | 金属流失的部位 | 氧化(金属溶解) |
| 阴极 | 电子接受的部位 | 还原(去极化剂反应) |
| 电解质 | 离子移动的路径 | 实现离子电流(例如水) |
| 金属路径 | 电子流动的路径 | 连接阳极和阴极(金属本身) |
您的实验室设备是否正遭受腐蚀困扰?
腐蚀会影响您的实验,损坏敏感仪器,并导致代价高昂的停机时间。KINTEK 专注于耐腐蚀实验室设备和耗材,帮助您保护投资并确保研究的完整性。
我们的专家可以帮助您选择合适的材料和解决方案,以中断您特定实验室环境中的腐蚀回路。
立即联系 KINTEK 进行咨询,了解我们如何帮助您对抗腐蚀并提升实验室性能。
图解指南