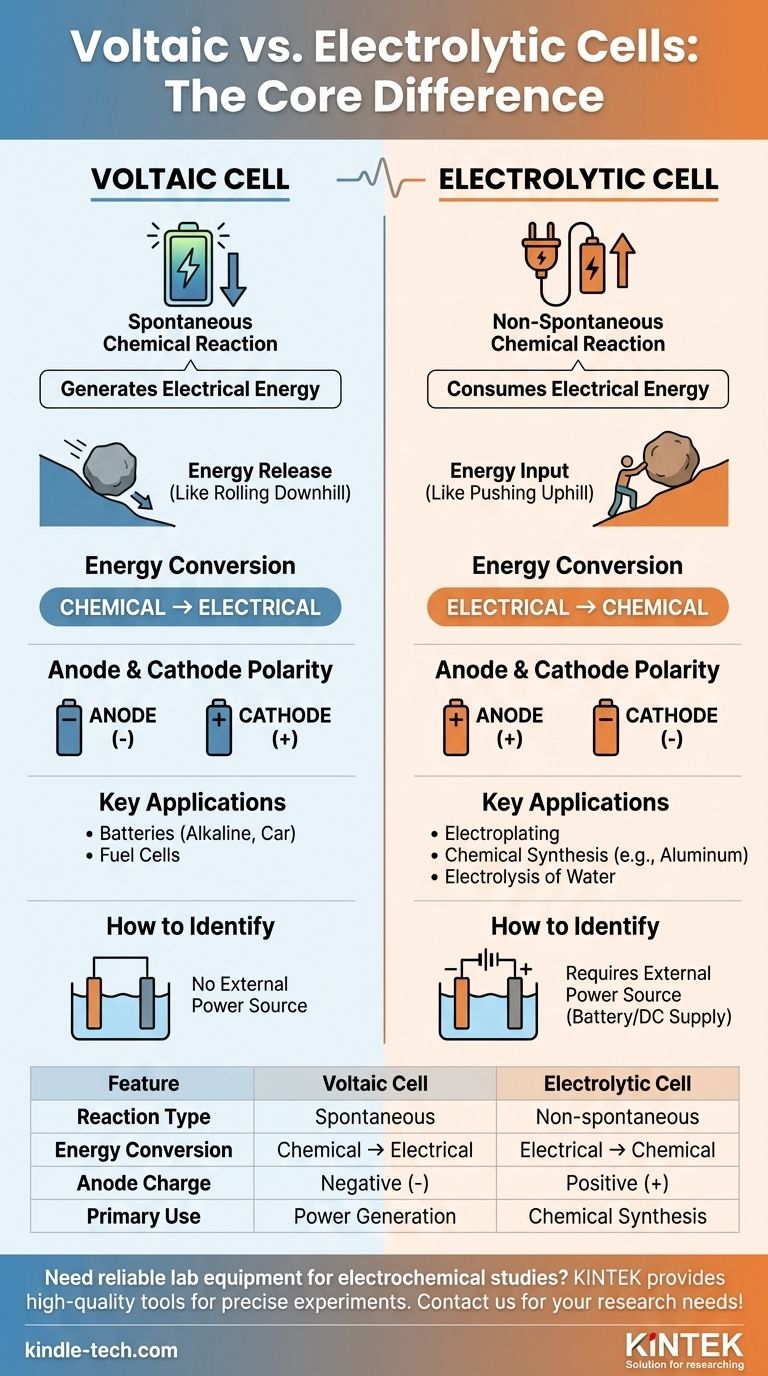
原电池和电解池之间的主要区别在于它们的基本目的和所涉及的化学反应的性质。原电池,例如常见的电池,利用自发化学反应来产生电能。相比之下,电解池利用外部电能来驱动不会自行发生的化学反应。
其核心区别在于能量流向。原电池是利用自发化学反应释放能量的电源。电解池是能量消耗者,它强制不自发的化学反应发生。
核心原理:自发性
区分这两种电池最重要的概念是化学反应是自发的还是非自发的。这决定了电池的整体功能和结构。
原电池:自发能量释放
在原电池(也称为伽伐尼电池)中,氧化还原反应是自发的。反应物的化学势能高于产物。
这种自然的反应趋势会释放能量,这些能量被转化为电流。可以把它想象成一块滚下山的巨石——它不需要任何外部推动就能发生。
原电池的标准电池电位(E°cell)总是正值,表明反应是自发的。
电解池:强制化学变化
在电解池中,氧化还原反应是非自发的。产物的能量状态高于反应物。
为了使这种反应发生,必须施加外部电源(如电池或直流电源)。这就像把巨石推上山——它需要持续的能量输入。
电解池中反应的标准电池电位(E°cell)是负值,这证实了它在没有外部帮助的情况下不会进行。

关键功能和结构差异
自发性的差异导致了这些电池在构造和操作方式上的几个关键区别。
能量转换
原电池将化学能转换为电能。它是一个化学发电机。
电解池则完全相反。它将电能转换为化学能,利用电力来产生新物质。
阳极和阴极的极性
这常常是混淆点,但如果你记住核心定义,它就很简单。在两种电池类型中,氧化始终发生在阳极,还原始终发生在阴极。
然而,这些电极的电荷是相反的:
- 在原电池中,阳极是自发反应中电子的来源,使其成为负极 (-)。阴极是电子被消耗的地方,使其成为正极 (+)。
- 在电解池中,外部电源决定了电荷。它将电子推向阴极,使其成为负极 (-)。它将电子从阳极拉走,使其成为正极 (+)。
实际应用
每种电池的应用直接反映了它们的功能。
原电池用于为设备供电。例子包括日常碱性电池、汽车电池(放电时)和燃料电池。
电解池用于合成和提纯。常见的应用包括电镀金属、生产纯铝以及水电解产生氢气和氧气。
常见误区和关键区别
为了避免常见错误,请关注电池的目的和外部电源的存在。
目的:发电 vs. 生产
区分它们最直接的方法是看它们的目标。电池是产生电能,还是利用电能来制造化学物质?前者是原电池;后者是电解池。
盐桥的作用
原电池通常由两个独立的半电池组成,通过盐桥连接。该组件对于在自发反应过程中离子流动时维持电荷中性至关重要。
电解池的结构通常更简单,通常在一个容器中进行,其中电解质本身允许离子移动。
外部电源
图表中外部电池或电源的存在是最清晰的视觉指示。如果你看到一个连接到电极的电源,你看到的是一个电解池。它的缺失意味着一个原电池。
为你的目标做出正确的选择
要识别电池类型或理解其功能,请考虑系统的主要目标。
- 如果你的主要重点是为设备供电:你正在使用原电池,它利用自发化学反应产生电流。
- 如果你的主要重点是生产纯物质(如氯气或铜金属):你正在使用电解池,它通过外部电源驱动非自发反应。
- 如果你正在分析一个带有外部电池的图表:这表示一个电解池,因为它提供了强制化学变化所需的能量。
理解自发产生和强制反应之间的这种根本区别是掌握电化学的关键。
总结表:
| 特点 | 原电池 | 电解池 |
|---|---|---|
| 反应类型 | 自发 | 非自发(需要外部电源) |
| 能量转换 | 化学能 → 电能 | 电能 → 化学能 |
| 阳极电荷 | 负极 (-) | 正极 (+) |
| 主要用途 | 发电(例如电池) | 化学合成(例如电镀) |
需要可靠的实验室设备进行电化学研究吗? KINTEK 专注于高质量的实验室设备和耗材,为您提供进行原电池和电解池实验所需的精确工具。从电极到电源,我们的解决方案有助于确保您实验室中结果的准确性和可重复性。立即联系我们,为您的研究需求找到完美的设备!
图解指南