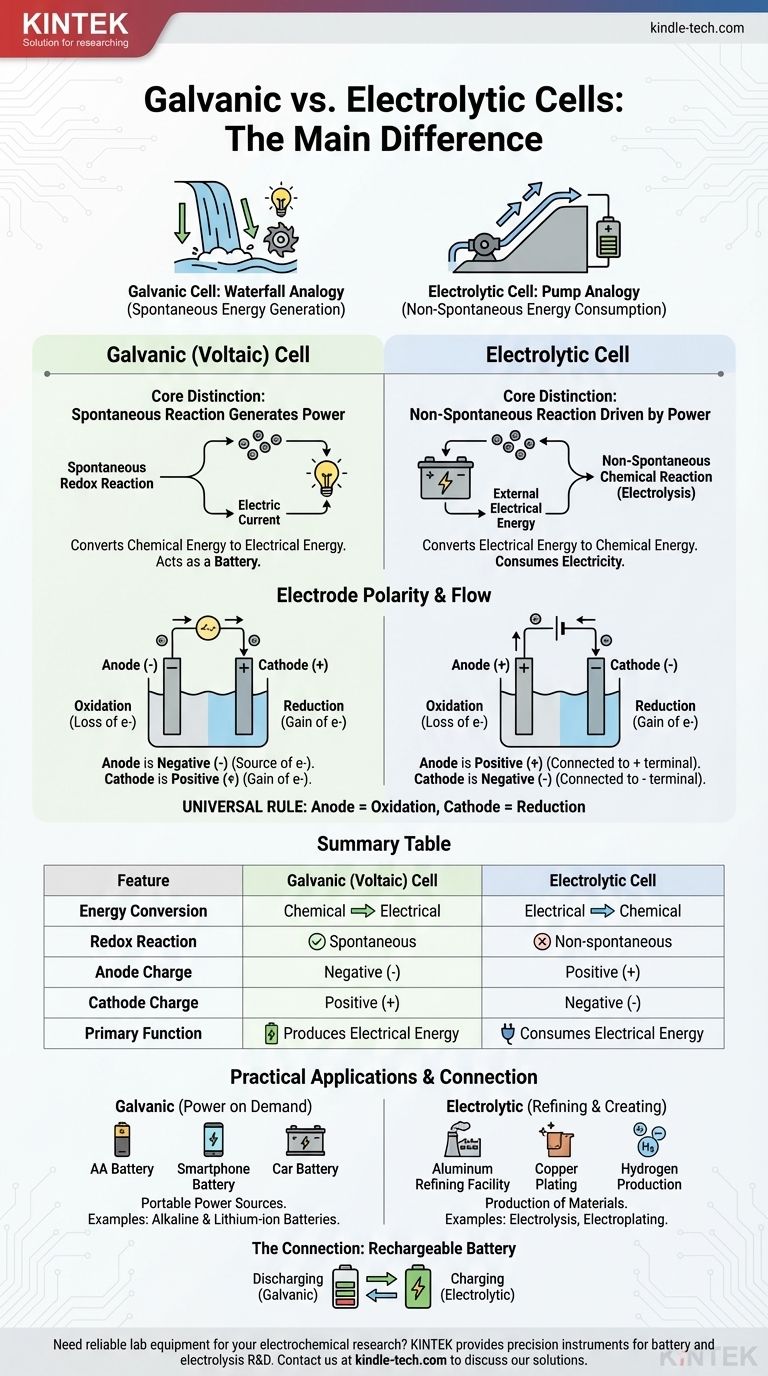
根本区别在于能量转换的方向和化学反应的性质。原电池自发地将储存的化学能转化为电能,有效地充当电池。相反,电解池利用外部电能来强制发生非自发化学反应。
可以将其视为瀑布发电和水泵耗电之间的区别。原电池就像瀑布,自然、自发的过程(水向下流)产生能量。电解池就像水泵,利用外部能量强制进行一个不会自行发生的过程(将水向上推)。
核心区别:自发性和能量流向
这两种电池的行为受一个原则支配:内部氧化还原反应是否会自行发生。
原电池:产生电能的自发反应
在原电池中,也称为伏打电池,所选的化学反应物具有相互反应的自然倾向。
这种自发氧化还原反应释放能量。电池的构造旨在将这种能量不以热量的形式,而是以定向电子流——电流的形式输送。
本质上,原电池利用自然发生的化学过程来做电功。这是所有电池背后的原理。
电解池:由电能驱动的非自发反应
在电解池中,化学反应是非自发的。反应物不会自行相互作用以产生所需的产物。
为了使反应发生,一个外部电源(如电池或电源)连接到电池。这种外部电压提供所需的能量,以强制电子移动并驱动化学变化。
电解池消耗电能以产生化学产物,这一过程称为电解。

深入了解电极极性
虽然“阳极”和“阴极”的术语是恒定的,但它们的电荷(极性)是一个常见的混淆点,因为它们在两种电池类型之间是相反的。关键是要记住是什么驱动了电子流。
阳极:始终是氧化发生的地方
在两种电池类型中,阳极都被定义为发生氧化(失去电子)的电极。这个定义是普遍的。
阴极:始终是还原发生的地方
同样,阴极始终是发生还原(获得电子)的电极。这是第二个普遍规则。
关键转变:为什么极性会改变
极性的差异源于反应是自发的还是强制的。
在原电池中,阳极处自发氧化释放电子,产生负电荷。阳极是负极,因为它是在电路中推出电子的来源。
在电解池中,使用外部电源。其正极将电子从阳极拉走以强制氧化。因此,阳极连接到正极侧并成为正极。
| 特征 | 原电池(伏打电池) | 电解池 |
|---|---|---|
| 能量转换 | 化学能转化为电能 | 电能转化为化学能 |
| 氧化还原反应 | 自发 | 非自发 |
| 阳极电荷 | 负极 (-) | 正极 (+) |
| 阴极电荷 | 正极 (+) | 负极 (-) |
| 主要功能 | 产生电能 | 消耗电能 |
理解实际应用
这种根本区别导致了技术和工业中不同的用途。
原电池的应用:按需供电
原电池被设计为便携式电源。常见的例子包括所有类型的电池,从标准的AA碱性电池到手机中的锂离子电池。
电解池的应用:精炼和制造
电解池利用电能生产材料。关键的工业过程依赖于电解,例如从矿石中生产纯铝、精炼铜以及将水分解产生氢气和氧气。电镀,即将一层薄薄的金属(如银或铬)镀到另一个物体上,是另一种常见的应用。
联系:可充电电池的工作原理
可充电电池是两种电池类型在一个设备中的完美体现。
当它为您的设备供电(放电)时,它作为原电池运行。电池内部的自发化学反应产生电流。
当您插上电源充电时,充电器充当外部电源。它施加电压,强制发生非自发的逆反应,补充反应物。充电期间,电池作为电解池运行。
为您的目标做出正确选择
您的目标决定了您正在使用哪种电化学框架。
- 如果您的主要重点是从化学过程中发电:您描述的是原电池(伏打电池)。
- 如果您的主要重点是利用电能驱动特定的化学变化:您正在使用电解池。
- 如果您正在分析可充电电池:请记住它在放电时作为原电池运行,在充电时作为电解池运行。
最终,反应的自发性以及由此产生的能量流向是区分这两种电化学支柱的决定性特征。
总结表:
| 特征 | 原电池(伏打电池) | 电解池 |
|---|---|---|
| 能量转换 | 化学能转化为电能 | 电能转化为化学能 |
| 氧化还原反应 | 自发 | 非自发 |
| 阳极电荷 | 负极 (-) | 正极 (+) |
| 阴极电荷 | 正极 (+) | 负极 (-) |
| 主要功能 | 产生电能 | 消耗电能 |
您的电化学研究需要可靠的实验室设备吗?无论您是开发新的电池技术还是优化电解过程,KINTEK都能提供您的实验室所需的精密仪器和耗材。立即联系我们,讨论我们的解决方案如何为您的创新提供动力!
图解指南