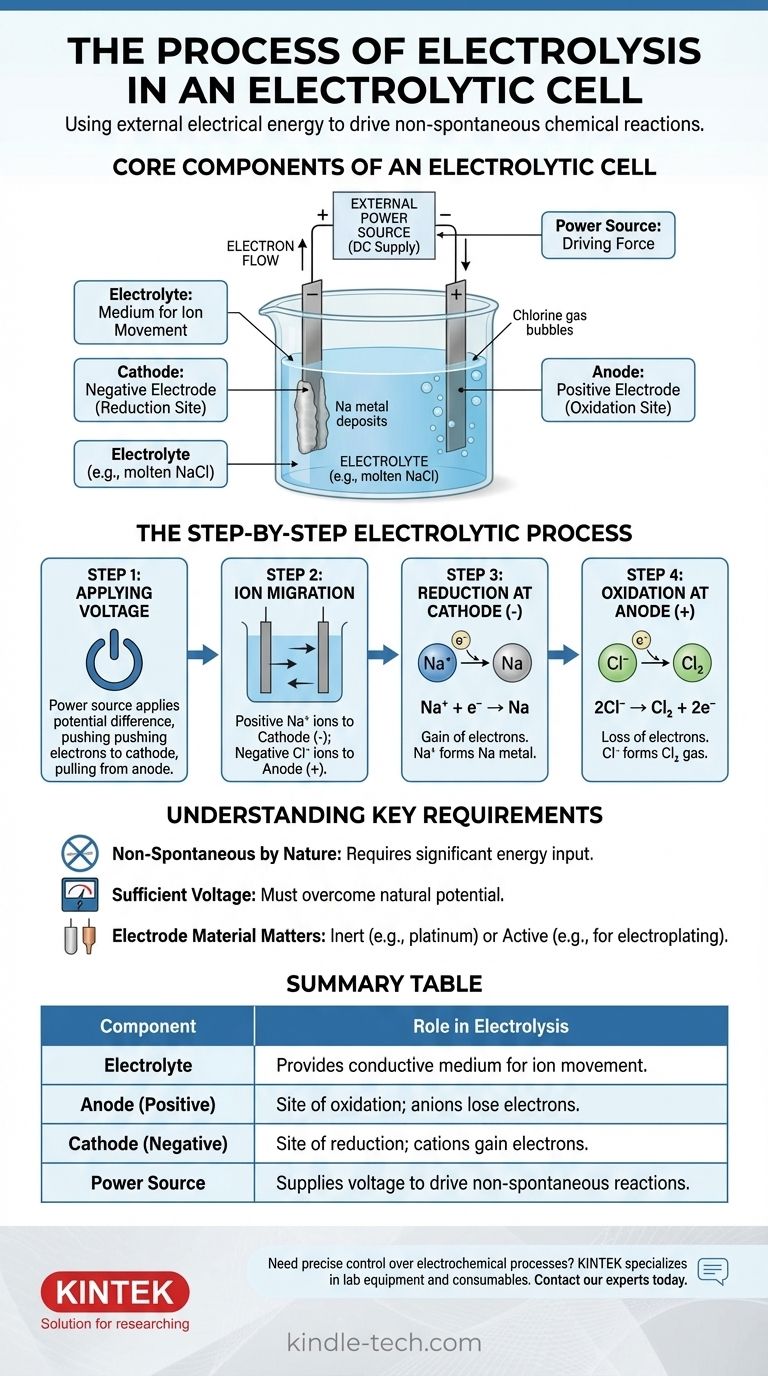
从本质上讲,电解是利用电能来驱动本身不会发生的化学反应的过程。外部电源在浸没在导电溶液或熔融盐(称为电解质)中的两个电极上施加电压。这种施加的能量迫使离子迁移到带相反电荷的电极上,并在那里通过氧化和还原反应发生分解。
电解池是逆转化学反应的引擎。通过施加外部电源,它迫使电子违背其自然倾向流动,从而促使稳定的化学化合物分解成其组成元素。
电解池的核心组成部分
要理解这个过程,您必须首先了解每个部分的功能。该系统是三个关键组件之间精心编排的相互作用。
电解质:离子运动的介质
电解质是一种含有自由移动离子的物质,这使其具有导电性。它通常是熔融的离子化合物,例如氯化钠(NaCl),或含有溶解离子的水溶液。
电解质的唯一目的是提供一个媒介,使带电离子能够在电极之间移动。
电极:阳极和阴极
电极是浸没在电解质中的导电材料(通常是金属或石墨)。它们充当电路与化学溶液相遇的物理界面。
在电解池中,极性由外部电源定义:
- 阳极是正电极。
- 阴极是负电极。
外部电源:驱动力
这通常是电池或直流电源。它的作用是在电极之间产生电位差,迫使电子向它们不会自发流动的方向移动。
这个外部电压是驱动整个非自发反应的“泵”,克服了电解质的自然化学稳定性。

分步电解过程
一旦电源激活,过程就会以精确的顺序展开。我们可以用熔融氯化钠(NaCl)的例子来说明这一点。
步骤 1:施加电压
施加外部电压。电源将电子推向一个电极,使其带负电(阴极),并将电子从另一个电极拉走,使其带正电(阳极)。
步骤 2:离子迁移
在熔融的 NaCl 电解质中,钠以正离子(阳离子,Na⁺)的形式存在,氯以负离子(阴离子,Cl⁻)的形式存在。
异性相吸:正 Na⁺ 阳离子被吸引到带负电的阴极,而负 Cl⁻ 阴离子被吸引到带正电的阳极。
步骤 3:阴极(负电极)上的还原
当 Na⁺ 阳离子到达带负电的阴极时,它们从电源接收一个电子。这种电子的得失是还原反应。
Na⁺ 离子被还原,形成中性钠金属(Na),沉积在阴极上。
步骤 4:阳极(正电极)上的氧化
同时,当 Cl⁻ 阴离子到达带正电的阳极时,它们各自向电极释放一个电子。这种电子的损失是氧化反应。
Cl⁻ 离子被氧化形成中性氯原子,这些原子配对形成氯气(Cl₂),从阳极逸出。释放的电子通过外部电路返回电源,完成电路。
理解关键要求
电解功能强大,但它在特定的限制下运行。忽略这些限制可能会导致实验失败或对结果产生误解。
本质上是非自发的
核心原则是电解驱动一个非自发反应。例如,将盐分解成钠金属和氯气需要大量的能量输入。没有外部电压,什么都不会发生。
需要足够的电压
外部电源必须提供足够高的电压,以克服化学反应的自然电势。如果电压太低,它将不足以迫使离子迁移和电子转移,反应将不会进行。
电极材料很重要
对于简单的分解,使用惰性电极(如铂或碳)。这些材料有助于电子转移,而它们自身不参与反应。在其他应用中,如电镀,阳极可以是“活性”电极,旨在被氧化并溶解到电解质中。
应用于常见示例
电解的原理是普遍的,但具体产物完全取决于所使用的电解质。
- 如果目标是生产纯金属:使用该金属的熔融盐作为电解质。纯金属将在阴极被还原并沉积,如工业生产钠和铝所示。
- 如果目标是分解水:在水中加入少量酸或盐以提高导电性。此过程将在阴极产生氢气(H₂),在阳极产生氧气(O₂)。
- 如果目标是电镀物体:待镀物体被设置为阴极。来自电解质溶液中的金属离子还原沉积到物体表面,形成一层薄而均匀的金属涂层。
通过控制电子的流动,我们可以直接控制和逆转化学过程,这是支撑现代工业很大一部分的基础能力。
摘要表:
| 组件 | 在电解中的作用 |
|---|---|
| 电解质 | 为离子运动提供导电介质(例如,熔融 NaCl)。 |
| 阳极(正极) | 氧化位点;阴离子失去电子(例如,Cl⁻ → Cl₂ 气体)。 |
| 阴极(负极) | 还原位点;阳离子获得电子(例如,Na⁺ → Na 金属)。 |
| 电源 | 提供电压以驱动非自发反应。 |
需要精确控制电化学过程? KINTEK 专注于电解、电镀和材料合成的实验室设备和耗材。我们可靠的电源、电极和电解质溶液可帮助您获得一致的结果——无论是分解化合物、提纯金属还是涂覆表面。立即联系我们的专家,讨论您实验室的具体需求!
图解指南