在任何电化学系统中,最关键的两个预防措施是确保正确的电极极性并为您的反应选择合适的电解质。极性决定了化学反应发生的位置,而电解质为该过程提供了必要的介质。两者之一出错都可能导致实验失败、设备损坏或严重的安全隐患。
电极的极性决定了化学反应的方向,而电解质决定了其可行性。两者之一不匹配将从根本上改变、抑制或主动破坏预期的电化学过程。
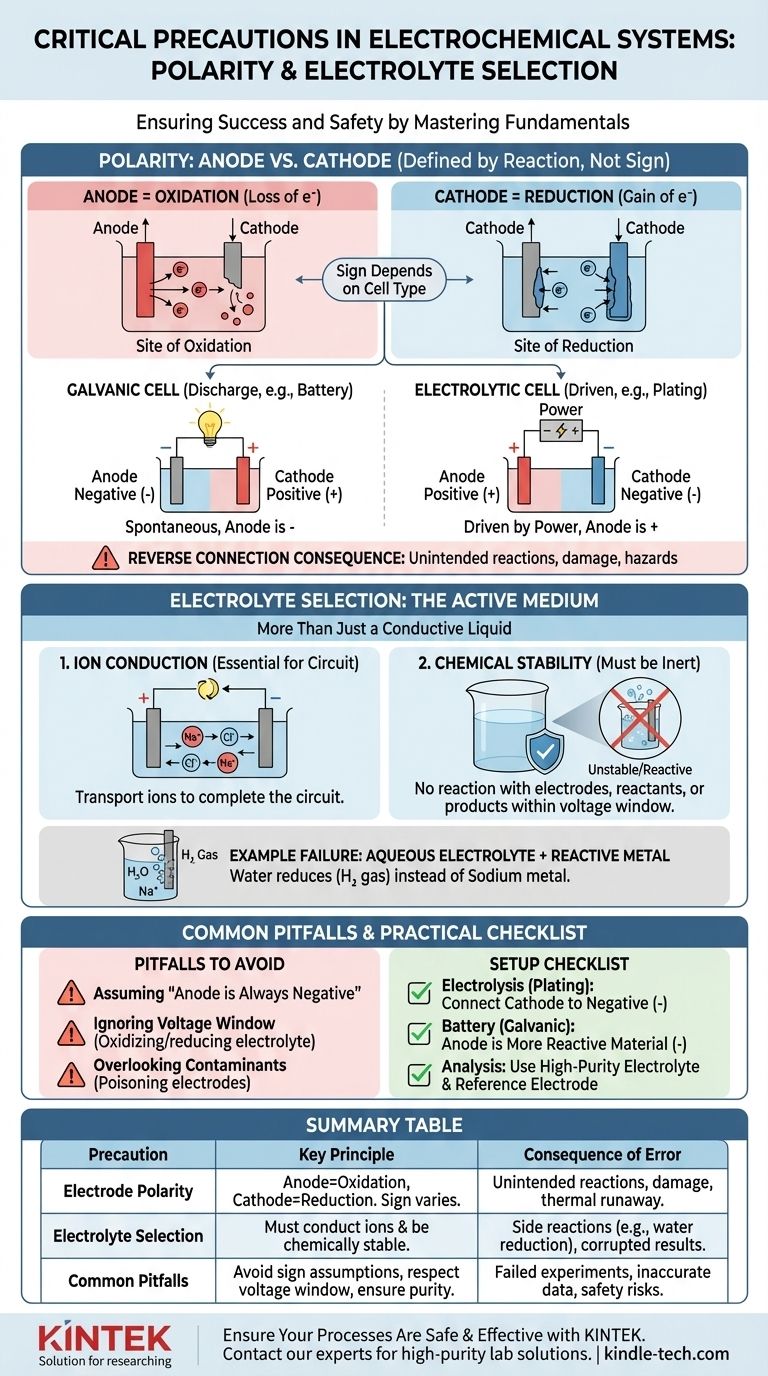
极性的关键作用:阳极与阴极
正确识别阳极和阴极是构建功能性和可预测的电化学电池的第一步。这不仅仅是简单地将端子标记为“正极”或“负极”。
“极性”的真正含义
阳极和阴极是根据反应类型定义的,而不是根据它们的电荷来定义的。
- 阳极总是发生氧化(电子损失)的部位。
- 阴极总是发生还原(电子获取)的部位。
混淆之处在于,这些电极的符号(+ 或 -)取决于电池的类型。在电池放电(原电池)中,阳极是负极。在电解装置(电解池)中,阳极连接到电源的正极。
连接反接的后果
错误地连接电极会迫使化学反应反向或以非预期的方式进行。
在电解池(例如电镀)中,反向连接意味着您将从打算进行电镀的电极上剥离材料,并将材料沉积到您的源阳极上,从而损坏两者。
在可充电电池中,反向极性充电可能导致电极结构发生不可逆的损坏,从而导致永久性容量损失、内部短路以及潜在危险的热失控。
电解质选择:不仅仅是导电液体
电解质不是被动的组件;它是电化学系统的活动且关键的部分。它的性质决定了哪些反应是可能的。
主要功能:离子传导
电解质最基本的工作是在阳极和阴极之间传输离子,以完成电路。如果没有离子流动的介质,整个反应将立即停止。
关键功能:化学稳定性
在操作条件下,电解质及其溶剂必须在化学上是惰性的。它们不应与电极、反应物或主要反应的产物发生反应。这就是安全规程中提到的“不必要的副反应”的来源。
示例:为什么水性电解质对活性金属无效
想象一下尝试通过电解氯化钠(NaCl)的水溶液来制取金属钠。
您可能期望钠离子(Na+)移动到阴极,获得一个电子,形成金属钠。然而,水(H₂O)也存在,并且比钠离子更容易被还原。结果是,您将在阴极产生氢气,而不会形成金属钠。电解质的选择使得所需的反应不可能发生。
理解权衡和常见陷阱
避免简单的错误需要理解控制所有电化学电池的基本原理。
陷阱 1:假设“阳极是负极”
最常见的错误是错误地识别阳极和阴极。请始终记住根据反应(氧化/还原)来定义它们,而不是根据固定的符号。确定您的电池是原电池(自发)还是电解池(由外部电源驱动)以分配正确的符号。
陷阱 2:忽略电解质的电压窗口
每种电解质都有一个稳定的电位窗口。如果您施加的电压超过此窗口,您将开始氧化或还原电解质本身,而不是您预期的目标。这会消耗能量,产生杂质,并阻止所需的反应。
陷阱 3:忽略污染物
即使是电解质中微量的杂质也会产生巨大影响。污染物可能会沉积在电极表面,使其“中毒”并阻止预期的反应,或者它们可以作为副反应的催化剂,从而破坏您的结果。
您的设置的实用清单
使用这些指南可确保您的实验设置从一开始就是正确的。
- 如果您的主要重点是电解(例如,电镀、精炼):将您想要电镀的电极(阴极)连接到电源的负极,将源材料(阳极)连接到正极。
- 如果您的主要重点是构建电池(原电池):发生氧化的化学活性更强的材料是您的阳极(负极),活性较弱的材料是您的阴极(正极)。
- 如果您的主要重点是精确的电化学分析:使用高纯度、通常脱气的电解质以防止副反应,并根据已知的标准或参比电极确认您的极性设置。
通过将极性和电解质选择视为基本设计参数,您可以从仅仅遵循说明转变为真正设计您所需的电化学结果。

总结表:
| 预防措施 | 关键原理 | 错误的后果 |
|---|---|---|
| 电极极性 | 阳极 = 氧化位点;阴极 = 还原位点。符号取决于电池类型(原电池与电解池)。 | 连接反接会导致非预期的反应(例如,剥离而不是电镀)、设备损坏或热失控。 |
| 电解质选择 | 必须传导离子并在操作条件下保持化学稳定(电压窗口)。 | 错误的电解质会促使副反应(例如,水还原而不是钠沉积)、破坏结果并浪费能量。 |
| 常见陷阱 | 假设“阳极总是负极”;忽略电解质电压窗口;忽略污染物。 | 由于非预期的化学过程导致实验失败、数据不准确和安全风险。 |
通过 KINTEK 确保您的电化学过程安全有效
您是否正在设置电解、电镀或电池开发项目?正确的电极极性和电解质选择对于获得准确的结果和维护安全是不可或缺的。在 KINTEK,我们专注于提供高纯度的实验室设备和耗材——包括电化学电池、纯电解质和可靠的电源——以支持您实验室的独特需求。
让我们帮助您避免代价高昂的错误和危险。立即联系我们的专家,讨论您的具体应用,并发现 KINTEK 的解决方案如何增强您的电化学工作流程。
图解指南