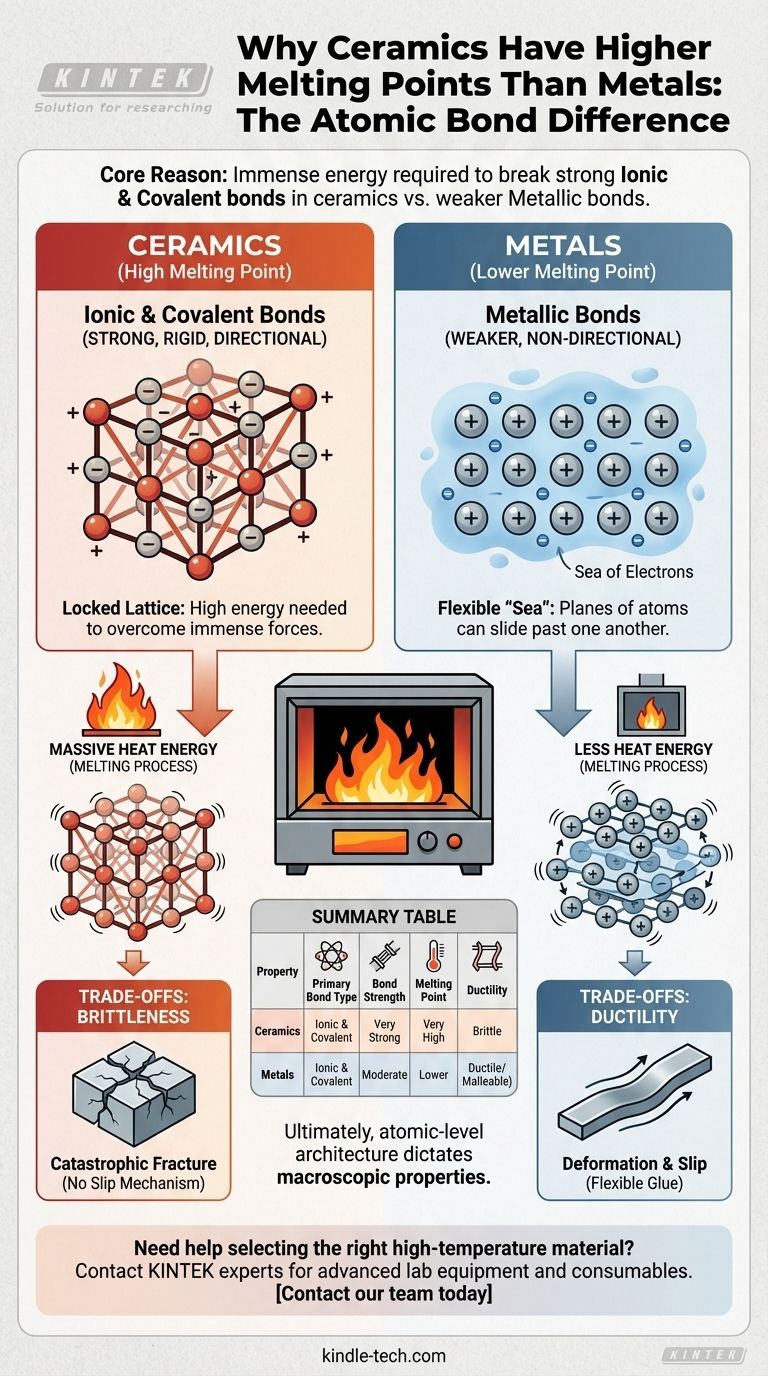
从根本上说,陶瓷和大多数金属之间熔点差异巨大,归结于它们原子键的根本性质。陶瓷由极其强大的离子键和共价键结合在一起,需要巨大的能量才能断裂;而金属则由较弱的、非方向性的金属键结合在一起。
其决定性原理很简单:材料的熔点是打破原子间结合所需的能量的直接衡量。陶瓷中强大的离子键和共价键形成了坚固、稳定的结构,需要比定义金属键的灵活“电子海”多得多的热能才能将其瓦解。
决定性差异:原子键合
要理解热学性质,我们首先必须理解原子是如何相互连接的。这些连接的类型和强度是决定材料熔点的主要因素。
金属键:电子的“海洋”
在金属中,原子的外层电子不与任何单个原子束缚。相反,它们形成一个围绕固定正金属离子晶格自由流动的离域“电子海”。
这种排列产生了强大的内聚力,但键是非方向性的。这使得原子平面可以相互滑动而不会发生灾难性断裂,这就是为什么金属具有延展性和可塑性的原因。
离子键:强大的吸引力
许多陶瓷是由离子键形成的,离子键发生在带正电的离子(阳离子)和带负电的离子(阴离子)之间。一个经典的例子是金属氧化物。
这些异性电荷之间强大的静电吸引力产生了非常强、坚硬且方向性强的键。这使得离子被锁定在一个高度稳定的晶体晶格中。
共价键:共享电子对
其他陶瓷,如碳化硅,由共价键定义。在这种情况下,原子共享电子以形成稳定的电子对,从而产生异常坚固和高度方向性的连接。
这种键合类型产生了已知的一些最坚硬、最耐热的材料,因为打破这些共享电子对需要巨大的能量。
陶瓷:强度的混合体
至关重要的是,大多数先进陶瓷表现出离子和共价特性的混合。这种组合产生了一种具有极高键能的原子结构,形成了一个坚固的框架,对热引起的原子振动具有极强的抵抗力。

结构如何决定热稳定性
键合决定了原子结构,而该结构决定了材料受热时的行为。
熔化:打破晶格的过程
熔化是提供足够热能,使原子或离子能够从其在晶体晶格中的固定位置挣脱的过程。热量仅仅是原子振动;温度越高,原子振动越剧烈。
为什么更强的键需要更多能量
要打破陶瓷坚硬、方向性锁定的晶格,其原子必须以足够的强度振动,以克服将它们固定在一起的巨大离子力和共价力。这需要非常高的温度。
相比之下,金属键的离域、非方向性性质使得晶格可以用明显更少的热能来破坏。
理解权衡
陶瓷的这种高热稳定性并非没有代价。提供强度的键合性质也带来了显著的局限性。
强度伴随着代价:脆性
赋予陶瓷高熔点的相同强大、方向性键也使其变得脆性。当陶瓷受到应力时,原子之间没有容易滑动的机制。
相反,坚硬的键会灾难性地断裂。任何微小的裂纹都会集中应力,并以极小的能量输入在材料中传播。
金属的优势:延展性
金属中的“电子海”充当灵活的胶水。它允许原子平面在应力下滑动和变形,而不会破坏材料的整体内聚力。
这种被称为延展性的特性,是较弱键的直接权衡,因此熔点也较低。
为您的应用做出正确选择
理解这些基本差异对于任何工程环境中的材料选择都至关重要。
- 如果您的主要关注点是高温结构完整性: 陶瓷是明确的选择,因为其强大的离子键和共价键赋予了卓越的热稳定性。
- 如果您的主要关注点是韧性、可成形性和抗断裂性: 金属是更好的选择,因为它们的非方向性金属键允许变形而不是灾难性失效。
- 如果您需要性能平衡: 考虑先进材料,如陶瓷-金属复合材料(金属陶瓷),它们旨在结合陶瓷的硬度和金属的韧性。
最终,材料的宏观特性是其原子级结构的直接反映。
总结表:
| 特性 | 陶瓷 | 金属 |
|---|---|---|
| 主要键合类型 | 离子键 & 共价键 | 金属键 |
| 键合强度 | 非常强 | 中等 |
| 熔点 | 非常高 | 较低 |
| 延展性 | 脆性 | 延展性/可塑性 |
需要帮助为您的应用选择合适的耐高温材料吗? 在 KINTEK,我们专注于为材料测试和研究提供先进的实验室设备和耗材。无论您是使用高熔点陶瓷还是延展性金属,我们的专家都可以帮助您为实验室的需求选择完美的解决方案。立即联系我们的团队,讨论我们如何支持您的研究并确保最佳性能!
图解指南