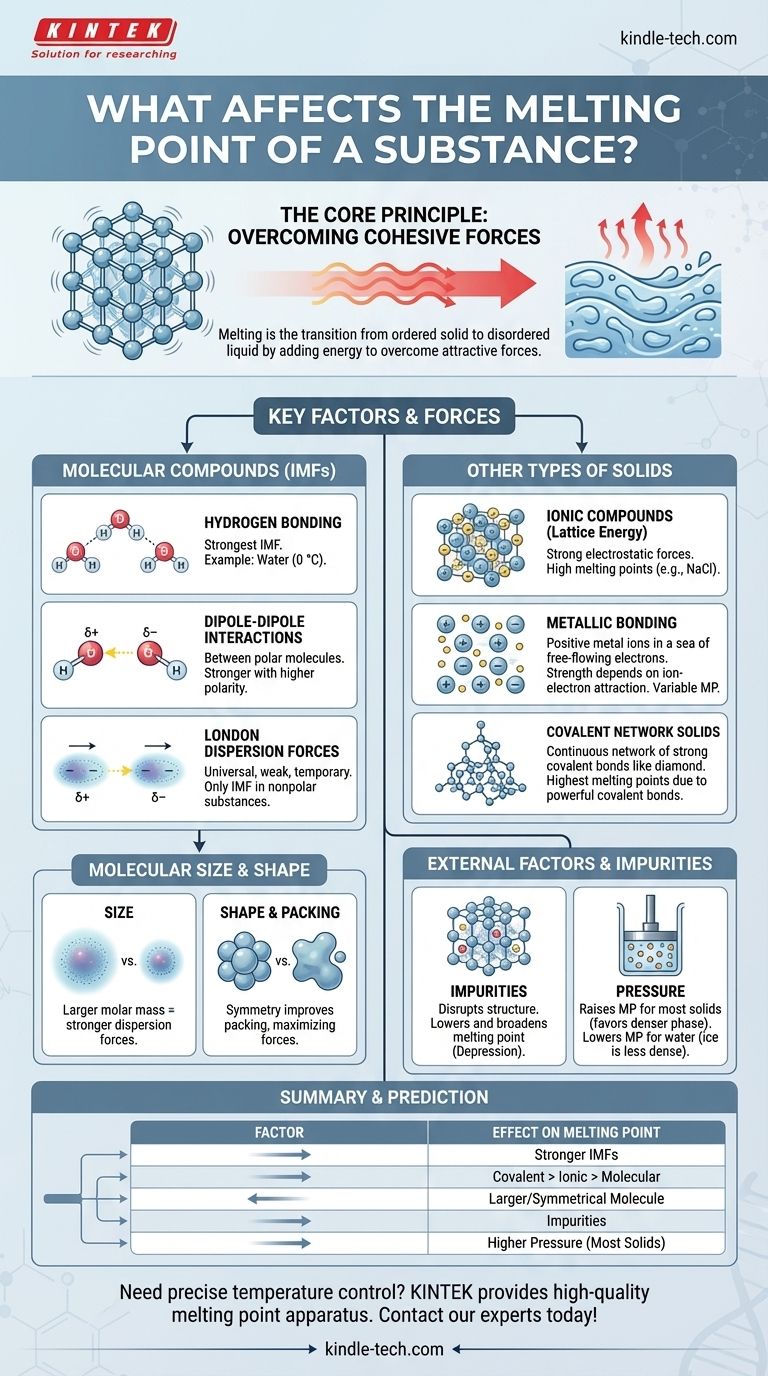
从根本上说,物质的熔点是由克服将其粒子固定在三维结构中的吸引力所需的能量决定的。主要因素是这些作用力(无论是化学键还是较弱的分子间作用力)的强度,以及粒子堆积的方式。分子大小、形状和杂质的存在等因素也起着关键作用。
核心原理很简单:粒子之间越强的吸引力需要越多的热能来打破,从而导致更高的熔点。熔点的整个故事就是对这些作用力如何产生和改变的探索。
核心原理:克服内聚力
熔化是从有序的固态到无序的液态的物理转变。理解这一转变是理解控制它的因素的关键。
什么是熔化?
在固体中,原子、离子或分子被锁定在一种固定的排列中,称为晶格。它们在原位振动,但不会相互移动。
熔化发生在特定温度下,此时这些粒子从热量中获得足够的动能,从而摆脱其固定位置并开始流动。
能量与内聚力
你添加到物质中的热量会增加其粒子的动能,导致它们更剧烈地振动。熔点是平衡温度,此时这种振动能量变得足够强大,足以克服将晶格结合在一起的内聚力。

分子化合物的关键因素
对于由离散分子(如水、蜡或糖)组成的物质,熔化过程中断裂的是分子之间的作用力,而不是分子内部的键。这些被称为分子间作用力 (IMFs)。
氢键:最强的分子间作用力
氢键是一种强大的偶极-偶极相互作用,发生在氢与高电负性原子(如氮 (N)、氧 (O) 或氟 (F))键合时。
水 (H₂O) 是一个经典的例子。它与大小相似的分子相比,具有较高的熔点 (0 °C),这完全归因于将分子结合在冰中的强大氢键网络。
偶极-偶极相互作用
这些作用力存在于极性分子之间,这些分子具有永久性的部分正电荷和部分负电荷端。一个分子的正端吸引其相邻分子的负端。
分子的极性越大,偶极-偶极吸引力越强,熔点越高。
伦敦色散力:普遍存在的力
这些暂时的、微弱的吸引力存在于所有分子中,无论是极性分子还是非极性分子。它们源于分子周围电子云的瞬时波动,产生瞬时偶极子。
对于甲烷 (CH₄) 或辛烷 (C₈H₁₈) 等非极性物质,伦敦色散力是唯一存在的分子间作用力。
分子大小和形状的作用
大小(摩尔质量):较大的分子具有较大的电子云,更容易被扭曲。这导致更强的伦敦色散力,从而导致更高的熔点。这就是为什么大的蜡状碳氢化合物在室温下是固体,而像甲烷这样的小分子是气体。
对称性和堆积:对称且紧凑的分子可以更紧密有效地堆积成晶格。这种紧密堆积最大限度地提高了分子间作用力的有效性,导致比相同大小的不规则形状异构体更高的熔点。
超越分子:其他类型的固体
并非所有固体都由离散分子组成。在许多材料中,熔化需要打破延伸到整个结构中的强大化学键。
离子化合物和晶格能
在像食盐 (NaCl) 这样的离子化合物中,正负离子通过强大的静电力(离子键)固定在刚性晶格中。熔化这些物质需要克服这种巨大的吸引力,这由晶格能衡量。
由于离子键比分子间作用力强得多,离子化合物具有非常高的熔点。
金属和金属键
金属通过金属键结合在一起,其中“电子海”在固定的正金属离子晶格中自由流动。
离子与电子海之间吸引力的强度决定了熔点。像钨和钛这样的金属形成非常强的金属键,并具有异常高的熔点。
共价网络固体
在这些材料中,原子通过连续的强共价键网络连接。没有单独的分子。
要熔化像金刚石(碳)或石英(二氧化硅)这样的共价网络固体,你必须打破这些强大的共价键。这需要巨大的能量,使它们成为所有物质类别中熔点最高的。
理解权衡和外部因素
物质的内在性质并非唯一影响因素。外部条件和组成也具有显著影响。
杂质的影响:熔点降低
杂质的存在会破坏晶格的均匀结构。这种弱化、无序的晶格需要更少的能量才能分解。
这种现象被称为熔点降低。这就是为什么纯物质具有尖锐、独特的熔点,而 impure 物质在较宽、较低的温度范围内熔化。这也是在冬季道路上用盐融化冰的原理。
压力的影响
对于大多数物质,固态比液态密度大。增加压力有利于密度更大的状态,使粒子更紧密地聚集在一起,使其更难挣脱。因此,对于大多数材料,更高的压力会提高熔点。
水是一个著名的例外。因为冰比液态水密度小,增加压力有利于液态,从而降低熔点。
如何预测相对熔点
使用这些原理来比较不同的物质并预测它们的行为。
- 如果你正在比较共价网络、离子和分子化合物:共价网络(例如,金刚石)最高,其次是离子(例如,盐),分子化合物(例如,糖)则低得多。
- 如果你正在比较分子化合物:首先,检查氢键,这是一个主导因素。如果不存在,比较极性。如果它们都是非极性或具有相似的极性,则摩尔质量较大的化合物通常具有较高的熔点。
- 如果你正在比较离子化合物:离子电荷较高和/或离子半径较小的化合物将具有更强的晶格能和更高的熔点。
- 如果你需要评估纯度:在已知熔点处急剧熔化的物质很可能是纯净的,而在低于预期熔点的范围内逐渐熔化的物质则是不纯的。
通过理解这些基本作用力,你可以有效地预测物质的微观结构如何决定其熔化行为。
总结表:
| 因素 | 对熔点的影响 | 关键原理 |
|---|---|---|
| 分子间作用力 (IMFs) | 分子间作用力越强,熔点越高 | 氢键 > 偶极-偶极 > 伦敦色散力 |
| 化学键类型 | 共价网络 > 离子 > 金属 > 分子 | 必须断裂的键的强度 |
| 分子大小/形状 | 摩尔质量越大且形状对称,熔点越高 | 增加伦敦力并改善晶格堆积 |
| 杂质 | 降低(熔点降低) | 破坏晶格,熔化所需能量减少 |
| 压力 | 升高(对大多数固体);降低(对冰/水) | 有利于密度更大的相(对大多数物质是固体,对水是液体) |
需要精确的温度控制进行材料分析吗?了解熔点对于材料表征、纯度评估和工艺开发至关重要。KINTEK 专注于提供高质量的实验室设备,包括熔点仪和熔炉,以帮助您的实验室获得准确可靠的结果。立即联系我们的专家,为您的特定应用找到完美的解决方案!
图解指南