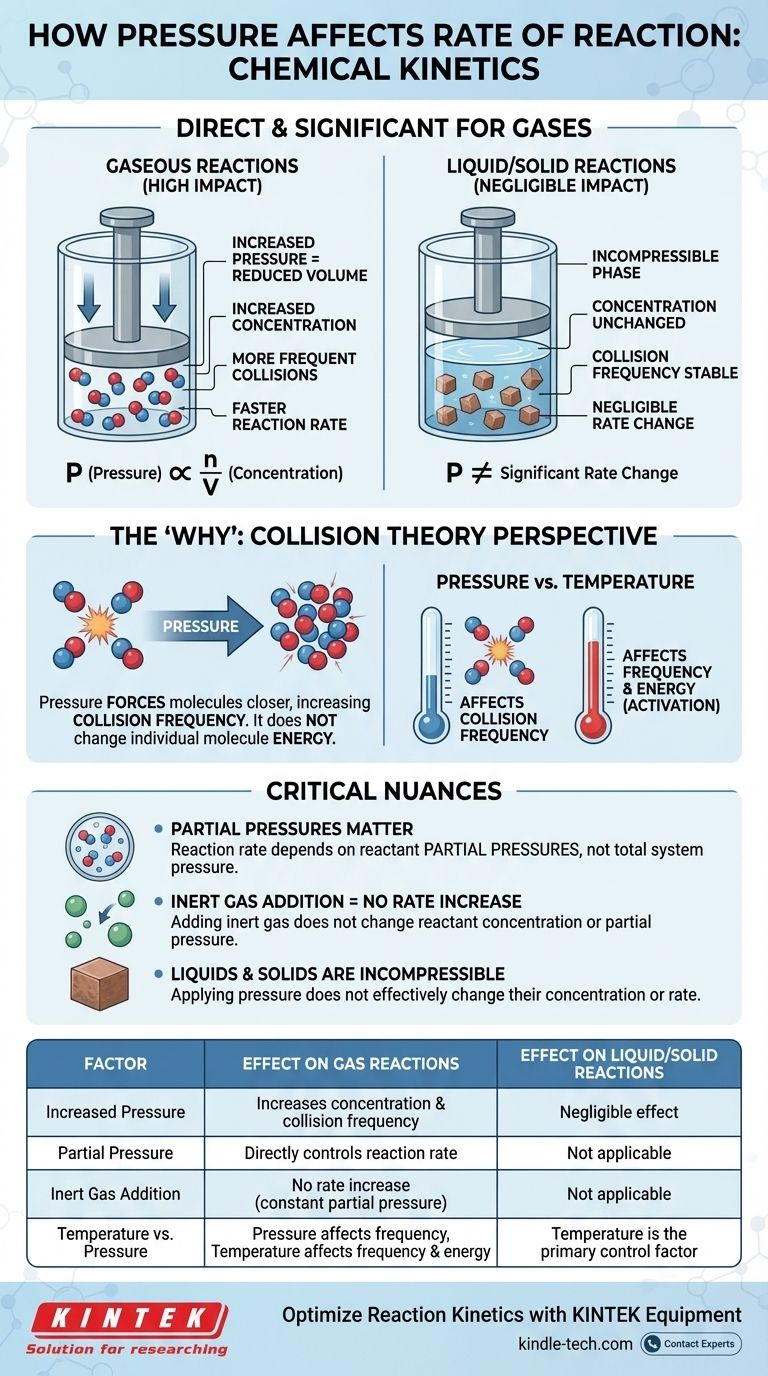
在化学动力学中,压力对反应速率的影响是直接且显著的,但仅限于涉及气体的反应。对于气态反应,增加压力会增加反应物分子的浓度。这会导致它们之间更频繁的碰撞,从而增加反应的总速率。对于纯粹发生在液相或固相中的反应,压力对速率的影响可以忽略不计。
压力与反应速率之间的关系,本质上是关于浓度的故事。对于气体而言,增加压力仅仅是一种物理手段,迫使更多的分子进入相同的体积,从而增加了有效碰撞的频率,加速了反应。
基本联系:压力作为浓度的替代指标
压力影响气态反应的核心原因在于它与浓度之间存在直接关系。这一原理最好通过考察化学基本定律来解释。
理想气体定律的作用
理想气体定律 PV = nRT 提供了数学上的联系。如果我们将其重新排列以求解压力 (P = (n/V)RT),我们可以看到压力 (P) 与 n/V 成正比。
术语 n/V 代表每单位体积的摩尔数 (n),这正是摩尔浓度的定义。因此,在恒定温度下增加系统的压力,就直接增加了其中气体分子的浓度。
浓度如何控制反应速率
反应的速度由其速率定律定义,通常表示为 rate = k[A]^m[B]^n。在这个方程中,[A] 和 [B] 代表反应物的浓度。
速率定律表明反应速率直接取决于反应物的浓度。浓度越高意味着速率越快。将此与气体定律联系起来,事件链变得清晰:增加压力会增加浓度,进而增加反应速率。

变化背后的“原因”:碰撞理论视角
速率定律告诉我们发生了什么,但碰撞理论解释了它在分子层面为什么会发生。要使反应发生,反应物粒子必须以足够的能量和正确的方向发生碰撞。
碰撞频率原理
化学反应是无数分子碰撞的结果。每秒发生的碰撞越多,成功反应发生的机会就越多。
压力如何促进碰撞
对气体施加压力会减小其占据的体积,迫使分子更靠近。这会显著增加它们的碰撞频率——即它们在单位时间内相互碰撞的次数。
虽然压力不会改变单个分子的能量(那是温度的作用),但它会使总碰撞事件的数量成倍增加。频率的增加导致成功、引发反应的碰撞成比例增加。
理解细微差别和权衡
虽然一般规则成立,但专家必须了解其适用的具体条件,更重要的是,了解何时不适用。
分压的关键作用
在气体混合物中,总反应速率取决于特定反应物的分压,而不是系统的总压。分压是单一气体如果单独占据整个体积时所施加的压力。
这意味着您可以通过向反应容器中添加惰性气体(如氩气或氮气)来增加总压。然而,由于这不会改变实际反应物的浓度或分压,因此它不会增加反应速率。
对液体和固体影响微乎其微
压力对凝聚相(液体和固体)中的反应速率影响可以忽略不计。这些物质状态已经被认为是不可压缩的。
液体和固体中的分子已经紧密堆积。施加外部压力不会显著减小它们之间的距离或改变它们的浓度。因此,它不是改变其反应速率的有效手段。
压力与温度
区分压力和温度的影响至关重要。
- 压力主要影响碰撞的频率。
- 温度影响碰撞的频率(分子移动更快),更重要的是,影响每次碰撞的能量。
提高温度会增加拥有所需最小活化能的分子比例,使其成为比压力更强大的提高反应速率的因素。
为您的系统做出正确选择
理解这一原理使您能够根据特定目标控制反应结果。在设计或优化化学过程时,请考虑以下因素。
- 如果您的主要目标是最大化气态反应的速度:通过减小系统体积来增加系统压力是提高产量的直接有效方法。
- 如果您的主要目标是控制气体混合物中的反应:您必须管理反应物的分压,因为仅仅添加惰性气体来提高总压并不会加速您的目标反应。
- 如果您的主要目标是改变液体或固体中的反应速率:操纵压力不是一个可行的策略;您应该专注于改变温度、溶解物质的浓度或使用催化剂。
通过理解压力是气体中浓度的替代指标,您可以精确控制系统的动力学。
总结表:
| 因素 | 对气体反应的影响 | 对液体/固体反应的影响 |
|---|---|---|
| 压力增加 | 增加浓度和碰撞频率 | 影响可忽略不计(不可压缩) |
| 分压 | 直接控制反应速率 | 不适用 |
| 惰性气体添加 | 速率不增加(分压恒定) | 不适用 |
| 温度与压力 | 压力影响频率;温度影响频率和能量 | 温度是主要的控制因素 |
需要精确控制您的化学反应吗? KINTEK 专注于提供高质量的实验室设备,包括压力反应器和气体处理系统,帮助您优化反应动力学并在实验室中取得卓越成果。立即联系我们的专家,讨论您的具体应用并发现满足您需求的正确解决方案。
图解指南