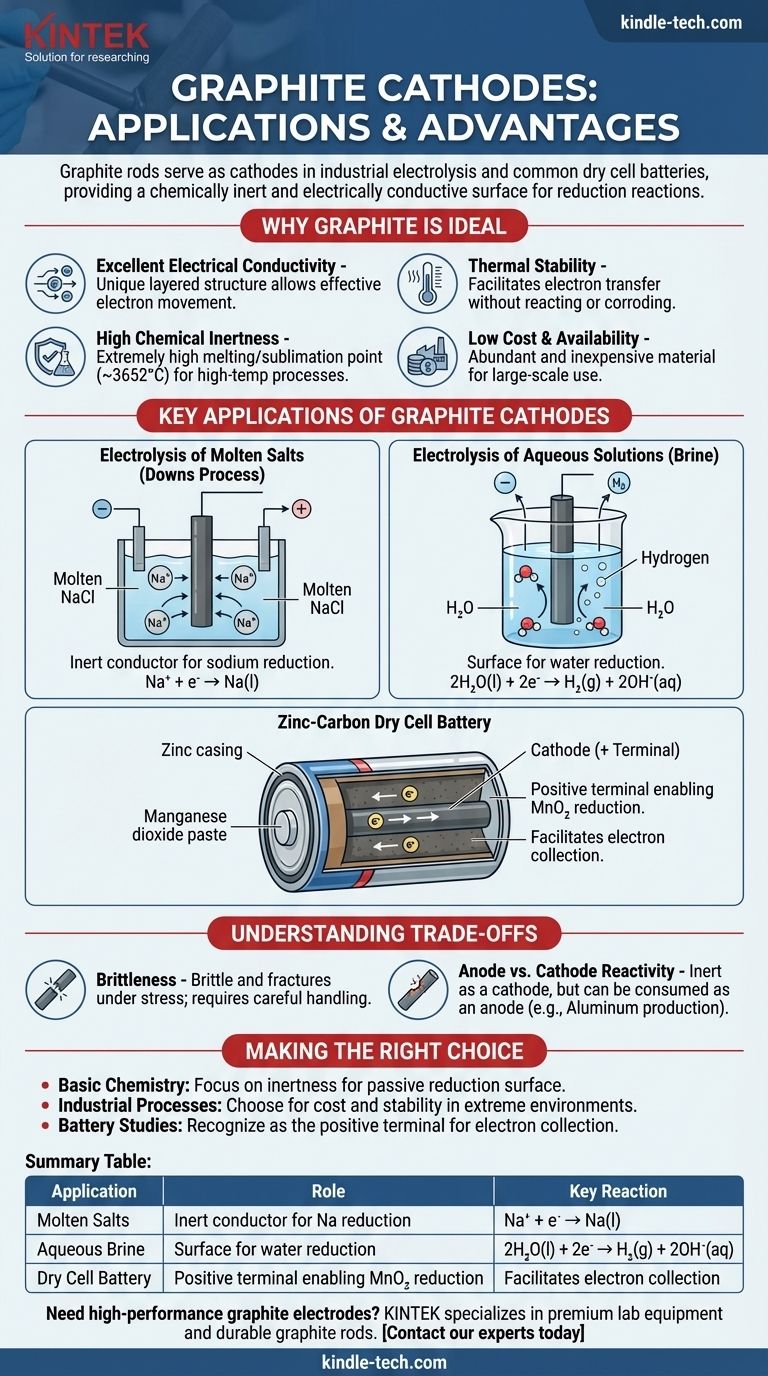
石墨棒在几个关键的电化学过程中充当阴极,最显著的是在工业盐电解和常见的干电池中。在这些应用中,石墨棒的主要功能不是被消耗或反应,而是作为一种化学惰性且导电的表面,在其中可以发生还原反应。
选择石墨作为阴极材料不是因为它参与了主要反应,而是因为它是一种优良的惰性导体。其导电性、耐化学性、高热稳定性和低成本的独特组合使其成为发生还原半反应的理想平台。
为什么石墨是理想的阴极材料
电极材料的选择是任何电化学电池中至关重要的设计选择。石墨(碳的一种特定形式)具有一系列特性,使其非常适合充当阴极。
优异的导电性
石墨具有独特的层状平面结构。在这些层内,离域电子可以自由移动,使石墨能够非常有效地导电,这是任何电极都必需的特性。
高化学惰性
作为阴极,电极必须促进电子转移到电解质中的物质,而自身不发生反应。碳相对不活泼,特别是与大多数金属相比,这意味着它不会腐蚀或干扰所需的化学过程。
热稳定性
石墨是所有元素中熔点/升华点最高的(约3652°C或6606°F)。这使得它非常适合高温电化学过程,例如熔盐电解,在这些过程中金属电极会熔化。
低成本和可用性
从工业角度来看,石墨是一种丰富且廉价的材料。这使得需要大型电极的大规模电化学生产在经济上可行。

石墨阴极的关键应用
了解具体的用例可以阐明理论。在每个示例中,石墨阴极只是电子被输送以引起化学变化的场所。
熔盐电解(唐斯法)
在从熔融氯化钠(NaCl)生产纯钠金属的过程中,石墨棒通常用作阴极。带正电的钠离子(Na⁺)被吸引到带负电的阴极,在那里它们获得一个电子并被还原成液态钠金属。
Na⁺ + e⁻ → Na(l)
石墨阴极仅为该反应提供表面和电子。
水溶液(盐水)电解
当电解氯化钠水溶液(盐水)时,石墨阴极扮演着类似的角色。然而,在这种情况下,水比钠离子更容易被还原。
因此,水分子在石墨阴极表面被还原,产生氢气和氢氧根离子。
2H₂O(l) + 2e⁻ → H₂(g) + 2OH⁻(aq)
锌碳干电池
在常见的“重型”电池中,中心棒由石墨制成,并充当阴极(正极)。它被二氧化锰(MnO₂)和其他化学物质的湿糊状物包围。
石墨棒从外部电路收集电子。还原反应发生在与棒相邻的糊状物中,其中二氧化锰被还原。石墨只是促进了这一过程。
理解权衡
虽然石墨非常有效,但它并非完美材料。认识其局限性是理解其应用的关键。
脆性
与具有延展性的金属不同,石墨易碎,在机械冲击或应力下可能会断裂。这需要在工业设计中进行仔细处理和支撑。
阳极与阴极反应性
虽然石墨作为阴极非常惰性,但当它在某些过程中用作阳极(氧化发生的位置)时,它可能会被消耗。例如,在铝生产中,碳阳极与产生的氧气反应形成二氧化碳气体,并被缓慢腐蚀。
电池类型之间的混淆
一个常见的混淆点是电极极性。阴极始终是还原发生的位置,但其符号会根据电池类型而变化。
- 在电解池中(如盐电解),阴极是负极。
- 在原电池中(如电池),阴极是正极。
为您的目标做出正确选择
您询问石墨阴极的原因决定了哪个方面最重要。
- 如果您的主要关注点是基础化学:请记住,石墨是一种惰性导体,为还原反应提供了一个被动表面,而自身不发生反应。
- 如果您的主要关注点是工业过程:选择石墨是因为其成本效益以及在高温或腐蚀性环境中无与伦比的稳定性,而大多数金属在这种环境中会失效。
- 如果您的主要关注点是研究电池:认识到锌碳电池中的石墨棒充当正极(阴极),作为电子收集器,使周围化学糊状物中的还原反应得以进行。
最终,理解石墨作为阴极的作用在于认识到一种惰性、导电材料的力量,它可以在不干扰化学反应的情况下实现化学反应。
总结表:
| 应用 | 石墨阴极的作用 | 关键反应 |
|---|---|---|
| 熔盐电解(唐斯法) | 用于钠还原的惰性导体 | Na⁺ + e⁻ → Na(l) |
| 盐水水溶液电解 | 水还原的表面 | 2H₂O(l) + 2e⁻ → H₂(g) + 2OH⁻(aq) |
| 锌碳干电池 | 使MnO₂还原的正极 | 促进电子收集 |
需要用于您的电化学过程的高性能石墨电极吗? KINTEK 专注于优质实验室设备和耗材,包括专为卓越导电性和热稳定性而设计的耐用石墨棒。无论您是进行工业电解还是开发电池技术,我们的材料都能确保可靠、惰性的性能。立即联系我们的专家,为您的实验室需求找到完美的石墨解决方案!
图解指南