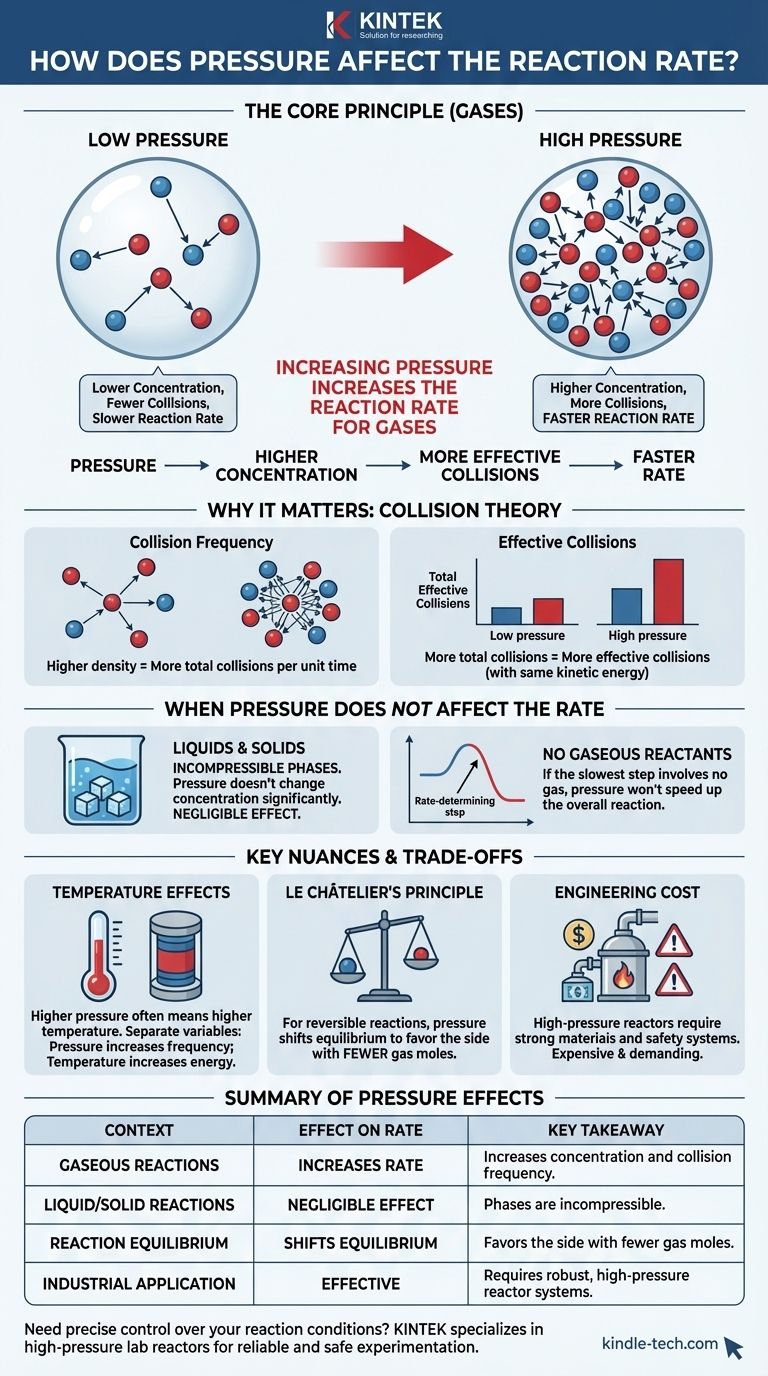
简而言之,增加涉及气体的反应的压力会提高反应速率。 发生这种情况是因为压力是衡量气体浓度的直接指标。通过将气体分子压缩到更小的体积中,您增加了它们相互碰撞和反应的可能性。
核心原则是,对于气相反应,压力充当浓度的直接控制杆。较高的压力迫使气体分子靠得更近,增加了有效碰撞的频率,从而加速了反应。这种效应对于液相或固相中的反应可以忽略不计。
基本机理:为什么压力很重要
要真正理解压力的影响,我们需要回到化学反应发生的第一个基本原理。这一切都围绕着粒子碰撞的概念。
压力作为浓度的量度
对于气体而言,压力不是一个抽象的力;它是气体分子撞击容器壁的结果。
理想气体定律在恒定温度 (T) 下,显示了压力 (P) 与给定体积 (V) 中摩尔数 (n) 之间的直接关系。在相同的空间中,更多的分子意味着更大的压力。因此,增加压力在功能上等同于增加浓度。
碰撞理论的作用
当反应物粒子碰撞并满足两个关键条件时,才会发生化学反应:
- 它们必须具有足够的动能来克服活化能垒。
- 它们必须以正确的物理方向发生碰撞。
满足这两个条件的碰撞称为有效碰撞。反应速率由这些有效碰撞的频率决定。
压力越大 = 碰撞越多
当您增加气态系统的压力时,您是将相同数量的分子强行压缩到更小的体积中。
这种更高的密度意味着分子之间的平均距离减小。因此,每单位时间发生反应物分子之间总碰撞次数会显着增加。
对“有效”碰撞的影响
虽然增加压力会增加总碰撞次数,但它不会改变单个分子的动能(假设温度恒定)。
因此,有效碰撞的百分比保持不变。然而,由于总碰撞次数增加了,每秒的有效碰撞绝对数量也会增加。这就是推动反应速率提高的原因。

何时压力不影响速率
压力与反应速率之间的联系很强大,但并非普遍适用。了解它何时不适用至关重要。
液相和固相中的反应
液体和固体被认为是不可压缩相。施加外部压力不会显着改变它们的体积或其组成粒子之间的间距。
由于压力变化不会改变液体和固体中反应物的浓度,因此压力对仅在这些相中发生的反应速率的影响可以忽略不计。
不涉及气态反应物的反应
如果反应机理涉及多个步骤,则总速率由最慢的步骤决定,称为速率决定步骤。
如果该速率决定步骤不涉及任何气态反应物,则外部压力的变化不会影响总反应速率。
理解权衡和细微差别
控制压力是一种常见的工业策略,但它带来的重要考虑因素超出了简单的速率变化。
与温度效应的区别
在实践中,压缩气体会提高其温度。较高的压力和较高的温度都会提高反应速率,但原因不同。
区分变量至关重要。压力增加了碰撞的频率,而温度增加了碰撞的能量和力,使更高比例的碰撞有效。
勒夏特列原理和平衡
对于达到平衡状态的可逆反应,压力起着双重作用。根据勒夏特列原理,增加压力将使平衡位置向有利于气体摩尔数较少的一侧移动。
这是一个独立于动力学(速率)的概念。压力会提高正向和逆向反应的速率,但可能会改变产物和反应物的最终平衡。
高压的工程成本
建造和维护高压反应器在技术上要求很高且成本昂贵。材料必须足够坚固以承受应力,并且需要广泛的安全系统来防止灾难性故障。这种经济和安全的权衡是工业过程设计中的一个主要因素。
将其应用于您的目标
您使用压力的方法完全取决于您正在处理的化学体系以及您试图实现的目标。
- 如果您的主要重点是最大化气相过程的反应速度: 增加压力是一种直接有效的方法,前提是您可以管理相关的温度变化和工程成本。
- 如果您正在研究化学平衡: 请记住,压力会影响反应速率和最终的平衡位置,有利于气体分子较少的一侧。
- 如果您的反应仅涉及液体或固体: 改变外部压力不是控制反应速率的可行策略;请关注温度、浓度或催化剂。
通过了解压力与浓度的直接联系,您可以获得控制气相反应动力学的有力工具。
摘要表:
| 压力对反应速率的影响 | 关键要点 |
|---|---|
| 气相反应 | 通过增加浓度和碰撞频率来提高速率。 |
| 液相/固相反应 | 影响可忽略不计;相是不可压缩的。 |
| 化学平衡 | 使平衡向气体摩尔数较少的一侧移动。 |
| 工业应用 | 有效,但需要稳健的高压反应器系统。 |
需要精确控制您的反应条件? KINTEK 专注于高压实验室反应器和专为可靠和安全实验而设计的设备。无论您是优化气相反应速率还是研究化学平衡,我们的解决方案都能提供您所需的性能和安全性。立即联系我们的专家,为您的实验室独特的挑战找到最合适的系统。
图解指南