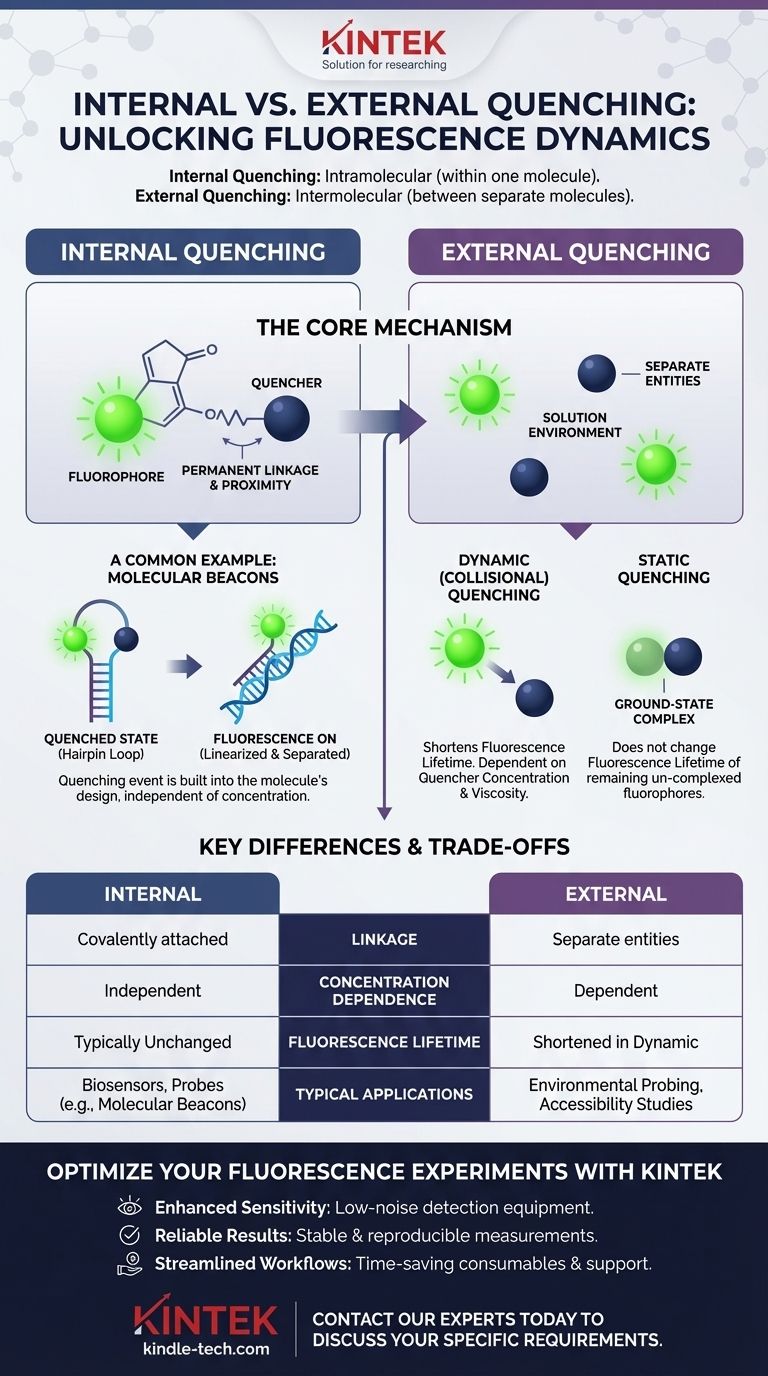
根本区别在于,内部猝灭发生在猝灭剂和荧光分子(荧光团)是同一分子的一部分时,而外部猝灭发生在它们是两个独立的分子,必须在溶液中相互作用时。内部猝灭是分子内过程(在一个分子内),而外部猝灭是分子间过程(在两个或更多分子之间)。
核心区别在于接近度和连接。内部猝灭涉及荧光团和猝灭剂永久性地连接在一起,而外部猝灭则依赖于溶液中独立分子之间的随机碰撞或复合物形成。
内部猝灭(分子内)的深入探讨
核心机制
在内部猝灭中,猝灭剂通过物理和共价键连接到荧光团上。这创建了一个单一的分子系统,其中两个组分始终紧密相连。
猝灭过程内置于分子设计中,因此与分子的浓度无关。
工作原理
最常见的机制是福斯特共振能量转移(FRET)或接触猝灭。在这些系统中,受激荧光团将其能量转移到附近的猝灭剂,而不发射光子,从而有效地“关闭”荧光。
这种能量转移之所以高效,正是因为猝灭剂通过分子结构本身被紧密地固定住。
常见示例:分子信标
分子信标是内部猝灭的完美例证。它们是单链DNA探针,一端带有荧光团,另一端带有猝灭剂。
在天然状态下,它们形成一个发夹环结构,使荧光团和猝灭剂直接接触,从而抑制信号。当信标结合到其目标序列时,它会线性化,将两者分开,导致荧光显著增加。

了解外部猝灭(分子间)
核心机制
外部猝灭涉及荧光团和猝灭剂作为独立实体存在于溶液中。猝灭仅在它们恰好相互作用时发生。
此过程的效率高度依赖于诸如猝灭剂浓度和环境粘度等因素,这些因素控制着它们相遇的频率。
动态(碰撞)猝灭
这是最常见的外部猝灭形式。当猝灭剂分子与受激荧光团碰撞时,受激荧光团被去活化。
此过程缩短了荧光寿命——分子保持激发态的平均时间。这种关系由斯特恩-沃尔默方程描述。
静态猝灭
在静态猝灭中,猝灭剂在荧光团处于基态(未被激发之前)时,与荧光团形成稳定的、非荧光的复合物。
这减少了可发射光线的荧光团总数,但不改变剩余的、未形成复合物的荧光团的荧光寿命。
主要区别和权衡
接近度和连接
内部猝灭依赖于永久的共价键,确保猝灭剂始终在附近。这提供了一个可靠的开/关切换机制。
外部猝灭依赖于随机扩散和碰撞。组分之间没有连接,使得该过程对环境条件敏感。
浓度的影响
内部猝灭的效率是单个分子的固有属性,不依赖于其浓度。
然而,外部猝灭的效率与猝灭剂的浓度成正比。更多的猝灭剂分子意味着更频繁的碰撞和更多的猝灭。
诊断工具:荧光寿命
这是一个关键的区分因素。动态外部猝灭的独特之处在于它主动缩短了测量的荧光寿命。
内部猝灭和静态外部猝灭都降低荧光强度,但通常不影响仍能发光的荧光团的寿命。
典型应用
内部猝灭是工程生物传感器、探针和报告分子(如分子信标)的原理,其中特定事件(如结合)被设计为触发荧光变化。
外部猝灭通常用作实验工具,用于研究荧光团周围的环境,例如确定蛋白质的荧光标记部分是暴露于溶剂还是埋藏在内部。
为您的目标做出正确选择
了解这种区别使您能够精确地设计和解释荧光实验。
- 如果您的主要重点是设计用于检测的特定生物传感器:内部猝灭提供了可靠探针所需的强大、内置的切换机制。
- 如果您的主要重点是研究大分子上标记位点的可及性:外部猝灭是理想的工具,因为猝灭速率将报告该位点暴露于溶液中猝灭剂的程度。
- 如果您的主要重点是确认基态复合物的形成:静态外部猝灭,它在不改变寿命的情况下降低强度,是这种现象的直接指标。
最终,在这两种框架之间进行选择完全取决于您是需要猝灭事件作为预编程的分子功能,还是作为环境相互作用的指标。
总结表:
| 特征 | 内部猝灭 | 外部猝灭 |
|---|---|---|
| 机制 | 分子内(在一个分子内) | 分子间(在独立的分子之间) |
| 连接 | 共价连接的猝灭剂和荧光团 | 溶液中的独立实体 |
| 浓度依赖性 | 独立 | 取决于猝灭剂浓度 |
| 荧光寿命 | 通常不变 | 在动态猝灭中缩短 |
| 常见应用 | 生物传感器、分子信标 | 环境探测、可及性研究 |
使用 KINTEK 优化您的荧光实验
了解猝灭机制对于准确的荧光分析至关重要。无论您是开发灵敏的生物传感器还是研究分子相互作用,拥有合适的设备都是成功的关键。
KINTEK 专注于高质量的实验室设备和耗材,旨在满足荧光研究人员的精确需求。我们提供可靠的仪器,为您的关键实验提供所需的性能和一致性。
让我们帮助您实现:
- 增强灵敏度:通过优化低噪声检测的设备。
- 可靠结果:通过确保稳定和可重复测量的仪器。
- 简化工作流程:通过节省您时间和精力的耗材和支持。
准备好提升您实验室的能力了吗? 立即联系我们的专家 讨论您的具体要求,并了解 KINTEK 如何支持您的研究目标。
图解指南