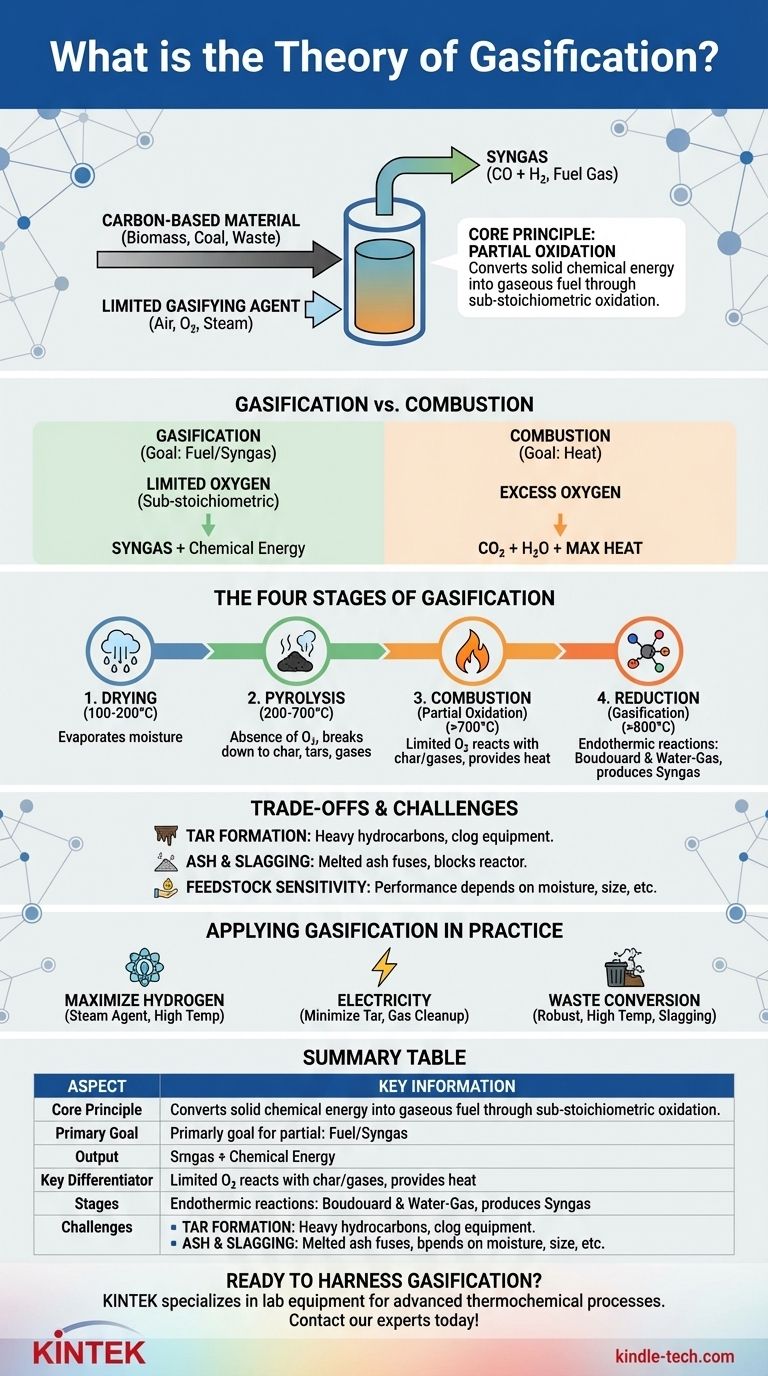
从本质上讲,气化理论描述了一种热化学过程,该过程将生物质、煤炭或废弃物等含碳材料转化为一种有价值的燃料气体,即合成气。它通过在受控环境中加热材料并加入有限量的“气化剂”(如氧气、空气或蒸汽)来实现这一目标,故意使其缺乏完全燃烧所需的足够氧气。
区分气化与简单燃烧的核心原则是部分氧化。气化不是完全燃烧燃料以释放热量,而是战略性地利用恰到好处的氧化作用,驱动一系列化学反应,将原料分解成富含氢气和一氧化碳的可燃气体混合物。
气化与燃烧:关键区别
要理解气化,首先必须将其与燃烧区分开来。它们是通过相似的手段实现的两个根本不同的目标。
气化剂的作用
燃烧旨在通过提供过量的氧气来实现完全氧化,确保所有燃料燃烧,主要产生二氧化碳(CO2)、水(H2O)和最大的热量。
然而,气化使用低于化学计量的气化剂用量。这意味着氧气不足以完成燃烧过程,从而迫使发生不同的化学途径。常见的气化剂包括空气、纯氧、蒸汽或CO2。
关键区别:燃料与热量
最终产物是主要区别。燃烧的目标是直接从燃料中释放热能。
气化的目标是将固体燃料的化学能转化为气态燃料(合成气)。这种合成气随后可以在其他地方燃烧以发电,或用作化学基础原料来生产氢气、甲醇和其他有价值的产品。

气化过程的四个阶段
气化不是单一反应,而是在气化炉内不同区域发生的四个不同热过程的序列。
阶段 1:干燥
当原料进入气化炉时,初始热量(通常为 100-200°C)会蒸发掉所有水分。这是一个简单的蒸发阶段,为下一阶段准备材料。
阶段 2:热解
在 200-700°C 左右,在缺氧条件下,开始热解。热量将原料复杂的碳氢化合物结构分解成三种主要产物:固体碳焦、可凝结蒸汽(焦油和油)和不可凝结的挥发性气体。
阶段 3:燃烧(部分氧化)
在此区域引入气化剂。一部分焦炭和热解产生的挥发性产物与有限的氧气发生放热反应(释放热量)。这个燃烧步骤至关重要,因为它产生了驱动最终、最重要还原阶段所需的高温(超过 700°C)。
阶段 4:还原(气化)
这是主要的产气阶段,发生在最高温度下(通常 >800°C)。在这种缺氧、高温的环境中,残留的焦炭和气体与燃烧过程中产生的蒸汽和二氧化碳发生几种吸热反应。
关键反应包括布杜瓦反应(C + CO2 → 2CO)和水煤气反应(C + H2O → CO + H2),它们将固体碳和中间气体转化为合成气中最终的富能组分。
理解权衡与挑战
尽管气化功能强大,但它是一个复杂的过程,存在必须加以管理的固有难题,才能成功运行。
焦油形成问题
焦油是在热解过程中产生的复杂重质碳氢化合物,它们在还原区未能分解。如果它们离开气化炉,它们可能会冷却、凝结并堵塞下游设备,如发动机和涡轮机,造成重大的操作问题。
灰渣问题
所有原料都含有无机、不可燃物质,这些物质会变成灰烬。在气化炉内的高温下,这些灰烬可能会熔化并聚集成玻璃状的炉渣,从而堵塞通道并损坏反应器的内衬。
原料敏感性
气化性能在很大程度上取决于原料的特性,包括其水分含量、灰分含量和物理尺寸。这意味着材料通常需要大量的预处理(干燥、粉碎)才能有效使用。
在实践中应用气化理论
理解核心原理可以让你根据具体目标来选择合适的技术。理论决定了实际结果。
- 如果您的主要重点是最大化氢气产量: 您应该优先选择蒸汽作为气化剂,并在高温下运行以有利于水煤气反应。
- 如果您的主要重点是使用发动机发电: 您的首要任务必须是通过反应器设计(例如下吸式气化炉)和有效的气体净化系统来最大限度地减少焦油含量。
- 如果您的主要重点是转化城市固体废物: 您需要一个坚固的高温气化炉(如等离子气化炉),它能够处理多样化、不一致的原料,并将灰烬熔化成无害的惰性炉渣。
归根结底,气化是将固体物质转化为多功能气态化学原料的受控艺术。
摘要表:
| 方面 | 关键信息 |
|---|---|
| 核心原理 | 部分氧化(低于化学计量的氧气) |
| 主要目标 | 将固体燃料转化为气态燃料(合成气) |
| 主要产物 | 合成气(富含CO和H2) |
| 关键区别 | 产生燃料气体,而不仅仅是热量(与燃烧不同) |
| 过程阶段 | 1. 干燥,2. 热解,3. 燃烧,4. 还原 |
| 常见挑战 | 焦油形成、灰渣问题、原料敏感性 |
准备好在您的实验室或中试项目中利用气化的力量了吗?
KINTEK 专注于为气化等先进热化学过程提供高质量的实验室设备和耗材。无论您是研究原料效率、优化合成气生产,还是开发新的清洁能源解决方案,我们可靠的反应器、温度控制系统和气体分析工具都旨在支持您的创新。
让我们一起构建您理想的气化装置。立即联系我们的专家,讨论您的具体实验室需求!
图解指南