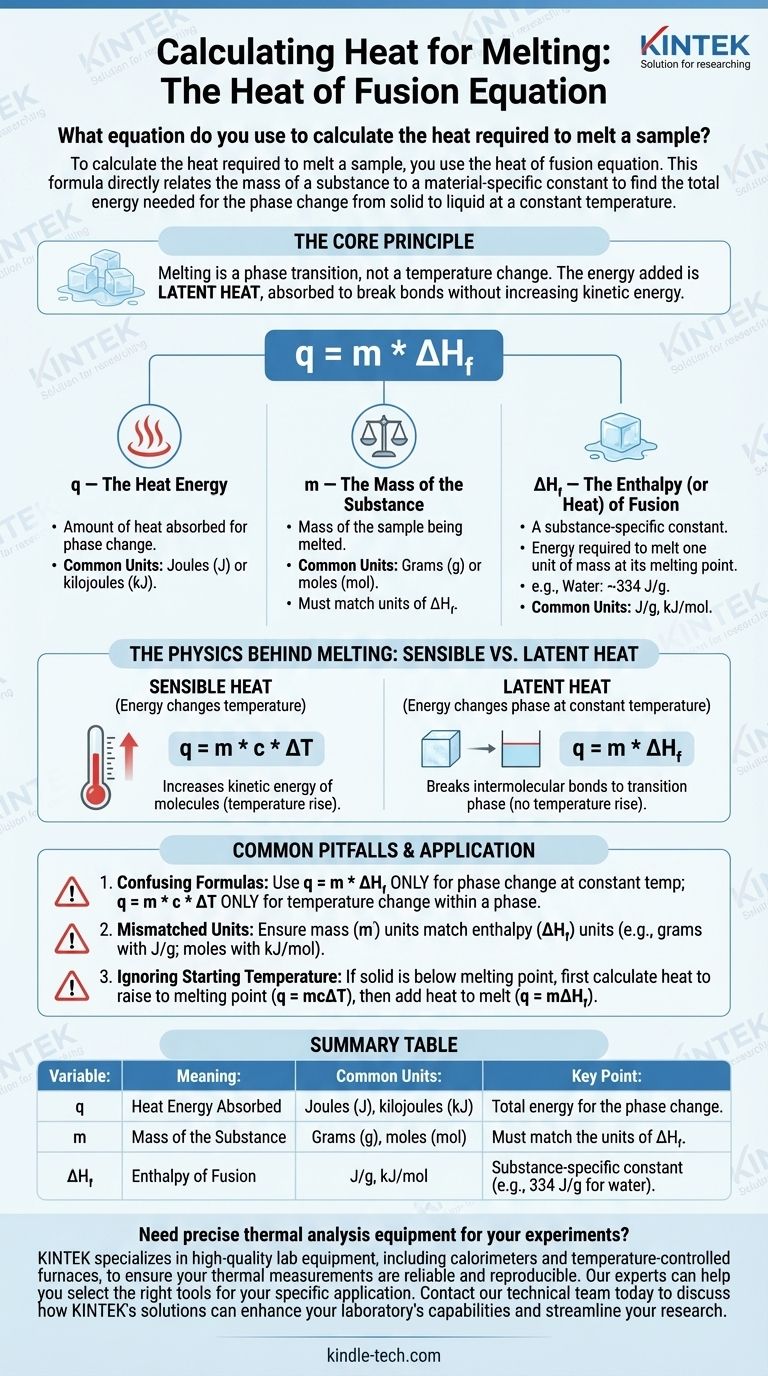
要计算熔化样品所需的热量,您需要使用熔化热方程。该公式直接将物质的质量与特定于材料的常数相关联,以求出在恒定温度下从固态转变为液态所需的总能量。
核心原理是熔化是一个相变过程,而不是温度变化。您加入的能量称为潜热,它被吸收以打破固体结构的键,而不会增加分子的动能。
解析熔化热方程
计算熔化过程中吸收的热量的公式是:
q = m * ΔH_f
该方程中的每个变量都代表物理过程中一个关键部分。单独理解它们是正确应用该公式的关键。
q — 热能
q 代表物质为发生相变而吸收的热量。该值通常以焦耳 (J) 或千焦耳 (kJ) 表示,尽管旧的上下文中可能使用卡路里 (cal)。
m — 物质的质量
m 是您要熔化的样品的质量。至关重要的是,质量单位,通常是克 (g) 或摩尔 (mol),必须与该物质的熔化热常数中使用的单位相匹配。
ΔH_f — 熔化焓(或熔化热)
ΔH_f 是最重要的变量。它是熔化焓,通常称为熔化潜热。
这是一个每种物质独有的物理常数。它定义了在熔点下熔化单位质量(例如 1 克或 1 摩尔)该物质所需的能量量。
例如,水的熔化热约为每克 334 焦耳 (J/g)。这意味着您必须向 0°C 的 1 克冰中加入 334 焦耳的能量,才能将其熔化成 0°C 的 1 克液态水。

熔化的物理学原理:显热与潜热
一个常见的困惑点是为什么熔化过程中温度不会升高。这可以通过两种热能的区别来解释。
显热
显热是改变物质温度的能量。当您加入显热时,您会增加分子的动能,使它们移动得更快,我们将其测量为温度升高。其公式为 q = m * c * ΔT。
潜热
潜热是在恒定温度下相变过程中吸收或释放的能量。在熔化过程中,输入的能量完全用于打破将固体的晶格结构结合在一起的分子间键,将其转变为液体。
由于能量“隐藏”在相变中而不是引起温度升高,因此它被称为潜热。
应避免的常见陷阱
应用错误的原理或公式是热力学计算中常见的错误来源。请注意这些常见的错误。
混淆熔化热与比热
最常见的错误是使用了错误的公式。
- 仅在恒定温度下发生相变时(例如,在 0°C 熔化冰)使用
q = m * ΔH_f(熔化热)。 - 仅在单一相中改变物质温度时(例如,将固体冰从 -10°C 加热到 0°C)使用
q = m * c * ΔT(比热)。
单位不匹配
务必检查您的单位。如果您的质量 (m) 是克,则您的熔化热 (ΔH_f) 必须是焦耳每克 (J/g)。如果 ΔH_f 以千焦耳每摩尔 (kJ/mol) 表示,您必须首先将样品质量转换为摩尔。
忽略起始温度
熔化热方程仅适用于物质已处于其熔点时。如果您有一个低于其熔点的固体,您必须执行两步计算:
- 计算将固体加热到其熔点所需的能量 (
q = mcΔT)。 - 计算在熔点熔化固体所需的能量 (
q = mΔH_f)。 - 将结果相加得到所需总热量。
应用正确的公式进行计算
为确保您正确解决问题,请确定您需要计算的确切过程。
- 如果您的主要重点是熔化已处于其熔点的物质: 您只需要熔化热方程:
q = m * ΔH_f。 - 如果您的主要重点是在不改变其相的情况下加热物质: 您只需要比热容方程:
q = m * c * ΔT。 - 如果您的主要重点是加热固体然后完全熔化它: 您必须分别计算两个步骤的热量并将它们相加:
q_total = (m * c * ΔT)_heating + (m * ΔH_f)_melting。
理解您正在模拟哪个物理过程是选择正确方程的关键。
摘要表:
| 变量 | 含义 | 常见单位 | 关键点 |
|---|---|---|---|
| q | 吸收的热能 | 焦耳 (J),千焦耳 (kJ) | 相变的总体能量 |
| m | 物质的质量 | 克 (g),摩尔 (mol) | 必须与 ΔH_f 的单位匹配 |
| ΔH_f | 熔化焓 | J/g,kJ/mol | 特定于物质的常数(例如,水为 334 J/g) |
您的实验需要精确的热分析设备吗?
准确计算热需求是材料科学、化学和制药学的基础。KINTEK 专注于高质量的实验室设备,包括量热仪和温控炉,以确保您的热测量可靠且可重复。
我们的专家可以帮助您为您的特定应用选择合适的工具,无论您是研究相变、材料合成还是反应动力学。
立即联系我们的技术团队,讨论 KINTEK 的解决方案如何增强您实验室的能力并简化您的研究。
图解指南
相关产品
- 带集成手动加热板的加热液压压机,用于实验室
- 24T 30T 60T 加热液压机,带加热板,用于实验室热压
- 实验室用圆柱形电加热压片模具
- 带加热板的自动加热液压压机,用于实验室热压 25T 30T 50T
- 实验室红外压片模具


























