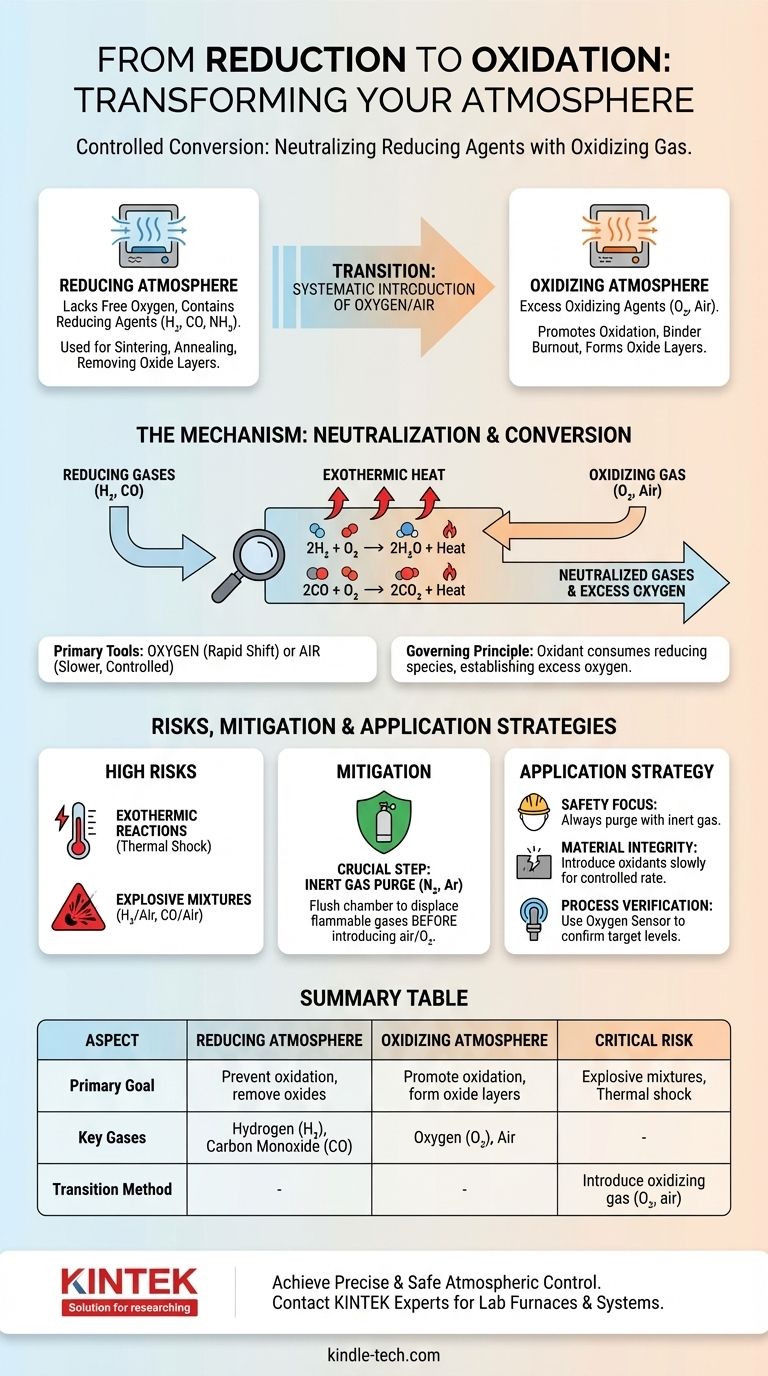
将还原气氛转变为氧化气氛是通过系统地引入氧化性气体(最常见的是氧气或空气)来实现的。这个过程通过与还原剂反应形成更稳定的分子,如水和二氧化碳,从而中和存在的活性还原剂(如氢气或一氧化碳),从根本上改变环境的化学势。
从还原气氛到氧化气氛的转变是一个受控的化学转化过程。这不仅仅是稀释;它是关于有意识地供应氧化剂以消耗还原物质并产生过量的氧气。
理解核心概念:还原与氧化
什么是还原气氛?
还原气氛是一种缺乏游离氧并含有活性还原剂的环境。这些还原剂,如氢气 (H₂)、一氧化碳 (CO) 或分解氨 (NH₃),很容易提供电子或从它们接触的材料中剥离氧原子。
这种气氛用于防止氧化或在高温处理(如烧结或退火)过程中主动去除金属和陶瓷上的氧化层。
什么是氧化气氛?
相比之下,氧化气氛含有过量的氧化剂,最普遍的是氧气 (O₂)。这种环境促进氧化,即材料失去电子或与氧结合的反应。
空气,其中约21%是氧气,是最常见的氧化气氛。这些环境对于陶瓷中的粘合剂烧尽或在材料表面形成特定氧化层等过程至关重要。
转变机制:从还原到氧化
原理:通过反应中和
转变的关键在于一个简单的原理:氧化剂会与还原剂反应并中和它们。要改变气氛,您必须引入足够的氧化剂来消耗所有存在的还原气体,然后建立过量。
氧气和空气:主要工具
氧气或空气是用于此转换的标准气体。它们之间的选择取决于所需的反应速度和所需的控制水平。
纯氧提供更强效和快速的转变,而空气则允许更慢、更稀释且通常更易于控制的转变。
控制化学反应
当氧气被引入典型的热还原气氛时,它会立即与还原剂反应。在处理温度下,主要反应是高度有利和自发的。
对于氢气气氛:
2H₂ (气) + O₂ (气) → 2H₂O (气) + 热
对于一氧化碳气氛:
2CO (气) + O₂ (气) → 2CO₂ (气) + 热
只有当所有H₂或CO都转化为H₂O或CO₂并建立了过量的O₂时,气氛才真正变为氧化性。
理解风险和权衡
放热反应的高风险
中和还原剂的反应是高度放热的,这意味着它们会释放大量的热量。快速引入氧气会导致炉内温度突然升高,可能损坏设备或产品。
这种热冲击会使敏感材料(如陶瓷)开裂,或导致金属中发生不希望的相变。
潜在的爆炸性混合物
最关键的风险是形成爆炸性气氛。氢气和空气(4%至75% H₂之间)或一氧化碳和空气(12%至75% CO之间)的混合物是爆炸性的。
如果存在点火源(例如热元件或静电放电),快速、不受控制地引入空气或氧气可能导致剧烈爆炸。安全协议不容谈判。
用惰性气体吹扫
为了减轻这些风险,通常会采用一个关键的中间步骤:用惰性气体吹扫。在引入空气之前,炉膛会用氮气 (N₂) 或氩气 (Ar) 等气体冲洗。
这种吹扫会排出易燃的还原气体,防止在最终引入氧气时形成爆炸性混合物。
如何将其应用于您的流程
受控的过渡对于安全和实现所需的材料性能至关重要。正确的策略完全取决于您的主要目标。
- 如果您的主要关注点是安全:在引入任何量的空气或氧气之前,务必用氮气等惰性气体吹扫还原气体。
- 如果您的主要关注点是材料完整性:缓慢且以受控速率引入氧化气体,以防止放热反应引起的热冲击。
- 如果您的主要关注点是过程验证:使用氧传感器或气体分析仪监测炉排气,以确认所有还原剂已被消耗,并且您已达到目标氧气水平。
掌握这种气氛转变使您能够精确控制材料的最终化学状态和物理性能。

总结表:
| 方面 | 还原气氛 | 氧化气氛 |
|---|---|---|
| 主要目标 | 防止氧化,去除氧化物 | 促进氧化,形成氧化层 |
| 关键气体 | 氢气 (H₂),一氧化碳 (CO) | 氧气 (O₂),空气 |
| 转变方法 | 引入氧化性气体(O₂,空气)以消耗还原剂 | 在还原剂被中和后实现 |
| 关键风险 | 转变过程中形成爆炸性混合物 | 放热反应引起的热冲击 |
在您的实验室中实现精确和安全的气氛控制。
掌握从还原气氛到氧化气氛的转变对于材料的完整性和操作员的安全至关重要。无论您是烧结金属、退火陶瓷还是开发新材料,正确的设备和专业知识都是必不可少的。
KINTEK专注于实验室炉和气氛控制系统,旨在实现精确、可靠和安全的操作。我们的解决方案帮助您:
- 通过集成安全功能防止爆炸性混合物。
- 控制热曲线以避免损坏您的样品。
- 通过兼容的监测设备验证过程结果。
让KINTEK成为您实验室卓越的合作伙伴。 立即联系我们的专家,讨论您的具体炉和气氛控制需求。我们提供设备和耗材,以确保您的流程既成功又安全。
图解指南